Рыба нототения отзывы: Нототения оптом, рыба нототения оптовая продажа | Defa group
Нототения в духовке
Я когда был маленьким, во времена тотального дефицита на продукты питания, самые распространенные виды мороженой рыбы были — треска, хек и минтай. В те времена такую рыбу как нототения, я как-то и не помню. В голове крутится только фраза «нототения порционная в зеленом соусе». Причем, откуда она появилась, и кто ее сказал — не помню. А вот жареная треска или хек — дома готовились часто.
Впрочем, весьма часто, принцип «кто не работает, тот ест» был не только фразой из популярного художественного фильма. Временами нам удавалось «достать», через связи, ценные деликатесные виды рыб — палтус, семгу, лосось и даже осетра. Обычно к празднику.
Сейчас рыба нототения вполне доступна и, что важно, недорогая. Продается практически везде. Еще в школе писал какой-то реферат о промысловых рыбах Антарктики. Помню что нототениевые — это большое семейство рыб, включает более полусотни видов. Особенность этих рыб — донный или придонный образ жизни и отсутствие плавательного пузыря (как у скумбрии). Жизнь в очень холодной воде, практически замерзающей отразилась на строении тела этих рыб.
Жизнь в очень холодной воде, практически замерзающей отразилась на строении тела этих рыб.
Среди нототениевых есть крупные рыбы, например — клыкачи разный видов. Но мы обычно видим в продаже небольшие тушки, как правило, без голов. Мясо нототении, наверное, самое экологически чистое, т.к. эту рыбу ловят в холодных морях вдали от цивилизации, где нет промышленных выбросов и стоков. Как я понял, большая часть некрупной рыбы в продаже, это «мраморная» нототения или Рамзая. Рыбки длиной 25-40 см, с темной спинкой. Так как любая рыба продукт скоропортящийся, поступает она в продажу в замороженном виде.
Как приготовить нототению? Извечный вопрос.
Как и всякая белая морская рыба с минимумом костей — очень вкусная, если пожарить ее. Пожарить, предварительно обваляв в муку или панировке. Минимум специй и подготовки. В детстве жареная таким способом рыба отлично употреблялась с картофельным пюре. Отличный вариант — нототения паровая (рыба на пару рецепт).
Учитывая, что в нототении сплошные витамины и полезные вещества, паровая рыбка превосходный диетический продукт. Очень неплохой вариант — рыба тушенная с луком и морковкой. Несмотря на то, что для этого больше походит крупная рыба, которую можно порезать кусками (минтай, треска), нототения может получиться порционной. Как бы то ни было, приготовление этой рыбы трудностей не вызывает.
Очень неплохой вариант — рыба тушенная с луком и морковкой. Несмотря на то, что для этого больше походит крупная рыба, которую можно порезать кусками (минтай, треска), нототения может получиться порционной. Как бы то ни было, приготовление этой рыбы трудностей не вызывает.
Мне больше всего нравятся рецепты, в которых нототения, да и любая другая рыба, готовится в духовке. С минимумом специй и без жидкости. Вкус при таком способе готовки получается изумительный. Расскажу о том, как мы готовим нототению, запекая ее на глиняном плато, и подаем с ароматным соусом из базилика и чеснока.
Нототения со свёклой рецепт с фото, как приготовить на Webspoon.ru
Готовим нототению со свёклой
Рыба нототения доступна в продаже по цене, и по качеству тушек хорошая. Сама рыбка имеет мясистую структуру со сладковатым вкусом. На вид мясо белое, в меру жирное. При приготовлении нототении главное не потерять её сочность, то есть не пересушивать. Предлагаемый мною рецепт нототении со свёклой, мне понравился очень давно. Поведали мне его как древний еврейский рецепт. Так ли это не знаю, уточнить нигде не нашла. Но то, что рыба была приготовлена очень вкусно, я оценила.
Поведали мне его как древний еврейский рецепт. Так ли это не знаю, уточнить нигде не нашла. Но то, что рыба была приготовлена очень вкусно, я оценила.
Как приготовить “Нототения со свёклой” пошагово с фото в домашних условиях
Шаг 1
Ссылка
Для приготовления нототении много специй не надо брать. Самый минимум — соль, перец. Муку для панировки рыбы. Для свёклы — лук, соль, сахар, уксус. Растительное масло для жарки.
Шаг 2
Ссылка
Поскольку свёкла уже старая, надо предварительно проварить свёклу (время в подготовку не включала). Молодую варить не надо.
Шаг 3
Ссылка
Тем временем готовим рыбу. Почистить от чешуи, удалить внутренности, срезать плавники, промыть холодной водой. Посолить и поперчить.
Шаг 5
Ссылка
И на быстром огне прожарить не до готовности, а так, чтобы только схватилась мука с маслом.
Шаг 6
Ссылка
После такой быстрой прожарки очень хорошо удаляются кости, что нужно и сделать. Сама рыба сохраняет форму, не крошиться.
Шаг 7
Ссылка
Свёклу и лук почистить. Лук нарезать, свёклу натереть на тёрку.
Шаг 9
Ссылка
Бросить свёклу, посолить, влить уксус и добавить сахар. Потушить вместе.
Шаг 10
Ссылка
В форму выложить свёклу.
Шаг 12
Ссылка
Сверху выложить лук. Его предварительно посолить, поперчить, полить маслом и смешать с мукой.
Шаг 13
Ссылка
В предварительно сильно нагретой духовке, довести рыбу до готовности минут 10.
Рыба на ужин (со словариком) — Дюссельдорф с Татьяной Щён
Вот, дарю вам мой рыбный словарик (немецко-русский +английский)))
Aal
Угорь
Eel
Aalquappe
Налим
Burbot
Adlerfisch
Серебристый горбыль
Croaker
Anchoveta
Перуанский анчоус
Anchoveta
Anchovis Sardelle
Хамса, Анчоус
Anchovy
Baltischer Hering
Салака
Baltic Herring
Bastard Makrele; Stöcker
Ставрида
Horse Mackerel
Bernsteinfisch
Японская лакедра
Yellowtail
Blauer Wittling
Путассу
Blue Whiting
Blauleng
Голубая мольва
Blue ling
Bonito
Полосатый тунец
Skipjack
Brachsen, Brassen
Лещ
Bream
Brachsenmakrele
Морской лещ
Ray’s bream Pomfret
Buckellachs
Горбуша
Pink (Humpback) Salmon
Dornhai
Катран
Picked Dogfish
Dorsch
Треска
Cod
Echter Lachs
Семга
Atlantic salmon
Eisfisch
Ледовая рыба
Icefish
Flügelbutt
Мегрим
Megrim
Flunder, Butt
Речная камбала
European Flounder; Fluke
Flussbarsch
Окунь
Perch
Forelle
Форель
Trout
Fregattmakrele
Ауксида
Frigate Mackerel
Gabeldorsch
Нитеперый налим
Graeter Forkbeard
Gelbflossenthun
Желтоперый тунец
Yellowfin tuna
Goldbrasse, Dorade
Дорада
Gild Head Bream
Goldlachs
Аргентина
Sole; Mud Sole
Grenadierfisch
макруронус
Antarctic Grenadier Hoki
Grenadierfisch
Тупорылый макрурус
Rat tail Grenadier
Hecht
Щука
Pike
Heilbutt
Палтус
Halibut
Hering
Сельдь
Herring
Hornhecht
Сарган
Hornfisk
Japanische Sardine
Иваси
Japanese Pilchard
Kabeljau
Атлантическая треска
Cod
Kaiserbarsch
Берикс
Red bream
Karpfen
Карп, Сазан
Carp
Katfisch
Зубатка
Catfish, Wolffish
Ketalachs, Hundslachs
Кета
Chum (Keta Dog) Salmon
Kilka
Тюлька
Knurrhahn
Желтая тригла
Gurnard
Königslachs
Чавыча
Chinook (Spring King)
Lachs
Лосось
Atlantic salmon
Lachsforelle (Meerforelle)
Кумжа
Sea trout
Leng
Мольва
Ling
Liesche; Scharbe
Ершоватка
Dab (common)
Limande; Echte Rotzunge
Малоротая камбала
Lemon Sole
Lodde
Мойва
Capelin
Lumb, Brosme
Менек
Tusk (Cusk)
Maifisch
Европейская алоза
Shad
Makrele
Скумбрия
Mackerel
Makrelenhecht
Сайра
Pacific Saury
Marmorbarsch
Мраморная нототения
Antarctic cod
Meeraal
Морской угорь
Conger eel
Meeräsche
Кефаль
Mullet
Meerbarsch, Wolfsbarsch
Лаврак
Common bass
Meerbrassen
Белый пагель
Sea bream
Menhaden
Менхэден
Menhaden
Nawaga
Навага
Neunauge
Минога
Lampera
Pazifik Pollack
Минтай
Alaska Pollack
Pfeilhecht; Barracuda
Европейская барракуда
Barracuda; Sea Pike
Pilchard, Sardine
Европейская сардина
Pilchard (Europe)
Pollack
Серебристая сайда
Pollack
Regenbogenforelle
Стальноголовый лосось
Rainbow trout
Renke
Сиг
Whitefish
Stör
Осётр
Sturgeon
Rotbarsch
Золотистый морской окунь, клювач
Redfish ocean perch
Rotlachs (Blaurücken)
Нерка
Sockeye (Red) Salmon
Rotzunge
Красная камбала
Witch; Gray Sole
Säbelfisch
Угольная рыба
Sable fish, Black cod
Sardelle
Xамса
Anchovy
Schellfisch
Пикша
Haddock
Schnapper
Луциан
Snapper
Scholle
Морская камбала
Plaice
Schwarzer Heilbutt
Черный палтус
Greenland Halibut
Seebrasse; Sackbrasse
Полосатый спар
Sea bream
Seehase
Пинагор
Sea Hare
Seehecht
Mерлуза, налим
Hake
Seelachs
Сайда
Saithe (Pollock)
Seezunge
Морской язык, Солея
Sole (common)
Silberlachs
Кижуч
Coho (Silver) Salmon
Sprotte
Бальтийская килька, шпрот
Sprat
Stint
Корюшка
Smelt
Stintdorsch
Паут
Norway pout
Tiefenbarsch
Клювач
Redfish Ocean perch
Tilapia
Тиляпия
Tilapia
Unechter Bonito
Пеламида
Atlantic Bonito
Wachnja
Hавага
Wachna Cod
Weißer Thun
Альбакор
Albacore
Wels
Сом
Channel catfish
Wittling
Мерланг
Whiting
Zackenbarsch
Групер, Мероу
Groupers Seabasses
Zahnbrasse
Зубан
Dogs teeth
Zander
Судак
Pike perch
Виды антарктических рыб используют стратегию зимнего выживания, аналогичную спячке — ScienceDaily
Ученые обнаружили антарктический вид рыб, который использует стратегию зимнего выживания, аналогичную спячке. Ученые из Британской антарктической службы (BAS) и Университета Бирмингема впервые обнаружили, что антарктическая «треска» Notothenia coriiceps эффективно «помещает себя в лед», чтобы пережить долгую антарктическую зиму.
Ученые из Британской антарктической службы (BAS) и Университета Бирмингема впервые обнаружили, что антарктическая «треска» Notothenia coriiceps эффективно «помещает себя в лед», чтобы пережить долгую антарктическую зиму.
Исследование показало, что рыба активирует сезонный «переключатель» в экологической стратегии, переходя от стратегии, обеспечивающей максимальное питание и рост летом, к другой, сводящей к минимуму энергетические затраты на жизнь в течение долгой антарктической зимы.
Исследование показывает, что по крайней мере некоторые виды рыб могут впадать в состояние покоя, похожее на спячку, которая не зависит от температуры и предположительно обеспечивает сезонные энергетические выгоды. Ученым уже известно, что у антарктических рыб очень низкая скорость метаболизма и антифризные белки крови, которые позволяют им жить в воде, близкой к температуре замерзания. Это исследование показывает, что антарктические рыбы, которые уже живут в «медленной полосе» с чрезвычайно низкими темпами роста, метаболизма и плавательной активности, могут фактически еще больше подавлять эти метаболические процессы зимой.
Ведущий автор доктор Хэмиш Кэмпбелл, ранее работавший в Университете Бирмингема, Великобритания, а теперь работающий в Университете Квинсленда, Австралия, сказал: «Спячка — довольно сложная тема. Рыбы, как правило, не способны подавлять скорость своего метаболизма независимо от температуры. у рыб, как правило, прямо пропорциональна снижению температуры воды.Интересно, что у этой антарктической трески скорость метаболизма снижается зимой, хотя температура морской воды не сильно снижается.Кажется маловероятным, что небольшие зимние понижения температуры воды, которые действительно происходят, вызывают заметное снижение метаболизма. Тем не менее, существуют большие сезонные изменения в уровне освещенности: 24-часовой световой день летом сменяется месяцами темноты зимой, поэтому уменьшение освещенности зимой может быть причиной снижения скорости метаболизма».
Д-р Кейрон Фрейзер из BAS говорит: «Это наше первое понимание того, как эти рыбы живут зимой. Мы впервые в Антарктике использовали передовые технологии, сочетающие отслеживание свободно плавающих рыб в дикой природе и мониторы сердечного ритма для позволяют нам исследовать, как эти животные справляются зимой с проживанием в почти ледяной воде и почти полной темноте в течение нескольких месяцев подряд. Похоже, что они используют короткое антарктическое лето, чтобы получить достаточно энергии от кормления, чтобы пережить зиму. Состояние, похожее на спячку, в которое они впадают зимой, по-видимому, является механизмом снижения их энергетических потребностей до минимума. Интересный вопрос, на который нам еще предстоит ответить, заключается в том, почему эти рыбы сильно сокращают кормление зимой, когда пища все еще доступна.”
Похоже, что они используют короткое антарктическое лето, чтобы получить достаточно энергии от кормления, чтобы пережить зиму. Состояние, похожее на спячку, в которое они впадают зимой, по-видимому, является механизмом снижения их энергетических потребностей до минимума. Интересный вопрос, на который нам еще предстоит ответить, заключается в том, почему эти рыбы сильно сокращают кормление зимой, когда пища все еще доступна.”
Почему эти рыбы выбрали эту стратегию, похожую на зимнюю спячку, в настоящее время неясно, но, по-видимому, это обеспечивает энергетические преимущества.Традиционные взгляды на спячку постоянно подвергаются сомнению. Это исследование представляет новую группу животных, которые, по-видимому, используют стратегию, подобную гибернации, которая позволяет им выживать в течение долгих зим в одной из самых суровых сред на Земле.
Ссылка на журнал: На этой неделе в PLoS One 3(3): e1743 опубликована статья Хэмиша А. Кэмпбелла, Кейрона П. П. Фрейзера, Чарльза М. Бишопа, Ллойда Пека и Стюарта Эггинтона: Спячка антарктической рыбы: зимовать на льду. дои: 10.1371/journal.pone.0001743
Бишопа, Ллойда Пека и Стюарта Эггинтона: Спячка антарктической рыбы: зимовать на льду. дои: 10.1371/journal.pone.0001743
Об антарктической треске
Антарктическая треска (Notothenia coriiceps) оказалась изолированной от своих более тепловодных собратьев около 30 миллионов лет назад, когда сформировалось Антарктическое циркумполярное течение. У рыбы оливкового цвета широкая голова и узкое тело. Хотя ученым известно, что в его крови есть гликопротеиновый антифриз и что он поддерживает очень низкую частоту сердечных сокращений, менее 10 ударов в минуту, очень мало известно о его поведении или о том, как он эволюционировал, чтобы жить в экстремальных условиях Антарктиды.
Источник истории:
Материалы предоставлены Британской антарктической службой . Примечание. Содержимое можно редактировать по стилю и длине.
Когда плохие вещи случаются с хорошей рыбой: потеря экспрессии гемоглобина и миоглобина у антарктических ледяных рыб | Журнал экспериментальной биологии
Физиологов-компаративистов инстинктивно привлекают организмы, демонстрирующие превосходные физиологические характеристики. Это действительно является следствием знаменитого «принципа Августа Крога», который гласит: « Для большого числа задач будет какое-то животное по выбору или несколько таких животных, на которых это будет наиболее удобно изучать » (Krogh, 1929). ). Хотя мы можем не согласиться с грамматикой этого предложения, сама концепция неоспорима. В области сравнительной физиологии сердечно-сосудистой системы немногие группы животных могут соперничать с антарктическими ледяными рыбами в соответствии критерию, описанному Крогом. Именно на этой группе мы сосредоточим наш комментарий.
Это действительно является следствием знаменитого «принципа Августа Крога», который гласит: « Для большого числа задач будет какое-то животное по выбору или несколько таких животных, на которых это будет наиболее удобно изучать » (Krogh, 1929). ). Хотя мы можем не согласиться с грамматикой этого предложения, сама концепция неоспорима. В области сравнительной физиологии сердечно-сосудистой системы немногие группы животных могут соперничать с антарктическими ледяными рыбами в соответствии критерию, описанному Крогом. Именно на этой группе мы сосредоточим наш комментарий.
Антарктические ледяные рыбы (семейство Channichthyidae) являются одним из восьми семейств единственного подотряда окунеобразных Notothenioidei, которые доминируют в ихтиофауне, окружающей Антарктиду (отличные обзоры см. в Eastman, 2005; Kock, 2005). Они занимают самую холодную и термически стабильную морскую среду на Земле. Температура моря вблизи шельфового ледника Росса на станции Мак-Мердо в Антарктиде почти постоянна и составляет –1,9 °C (Littlepage, 1965), и даже на более северном Антарктическом полуострове летние температуры колеблются только между +1. 5°C до зимних температур –1,8°C (DeWitt, 1971). Водная толща к югу от Антарктического полярного фронта чрезвычайно хорошо перемешана по вертикали, и все глубины близки к полному насыщению кислородом. Поскольку растворимость кислорода в морской воде обратно пропорциональна температуре, холодные антарктические моря представляют собой исключительно богатую кислородом водную среду обитания.
5°C до зимних температур –1,8°C (DeWitt, 1971). Водная толща к югу от Антарктического полярного фронта чрезвычайно хорошо перемешана по вертикали, и все глубины близки к полному насыщению кислородом. Поскольку растворимость кислорода в морской воде обратно пропорциональна температуре, холодные антарктические моря представляют собой исключительно богатую кислородом водную среду обитания.
Нототениоиды составляют примерно 35% видов рыб и 90% биомассы рыб, обитающих к югу от Антарктического полярного фронта (Ekau, 1990).Радиация близкородственных нототениоидных видов происходила быстро (в течение последних 12 миллионов лет, млн. лет) (Bargelloni et al., 1994) и при очень необычных условиях. Во-первых, нототениоиды эволюционировали в относительной океанографической изоляции от других фаун из-за циркумполярных течений и глубоких океанских впадин, окружающих континент. Во-вторых, для Южного океана последние 10–14 млн лет характерны экстремально низкие температуры воды (Kennett, 1977). Наконец, эволюция этих рыб развивалась в условиях очень низкого уровня конкуренции ниш, потому что где-то между серединой третичного периода и настоящим временем в Южном океане произошел резкий спад разнообразия рыб (см. Eastman, 1993; Eastman, 2005).Эти особенности делают антарктических нототениоидных рыб исключительно привлекательной группой для изучения физиологических и биохимических адаптаций к низкой температуре тела. Сегодняшние нототениоиды, возможно, являются конечным результатом экстраординарного природного эксперимента. Они дают представление об исключительных физиологических характеристиках, которые могут возникнуть у животных, живущих при хронически низких температурах тела. Некоторые из этих характеристик явно являются адаптивными (например, выработка антифризных гликопротеинов). Другие были бы вредны, если не смертельны, в более теплой и более конкурентной среде.
Наконец, эволюция этих рыб развивалась в условиях очень низкого уровня конкуренции ниш, потому что где-то между серединой третичного периода и настоящим временем в Южном океане произошел резкий спад разнообразия рыб (см. Eastman, 1993; Eastman, 2005).Эти особенности делают антарктических нототениоидных рыб исключительно привлекательной группой для изучения физиологических и биохимических адаптаций к низкой температуре тела. Сегодняшние нототениоиды, возможно, являются конечным результатом экстраординарного природного эксперимента. Они дают представление об исключительных физиологических характеристиках, которые могут возникнуть у животных, живущих при хронически низких температурах тела. Некоторые из этих характеристик явно являются адаптивными (например, выработка антифризных гликопротеинов). Другие были бы вредны, если не смертельны, в более теплой и более конкурентной среде.
Одной из самых необычных и увлекательных физиологических особенностей антарктических нототениоидов является полная потеря гемоглобина (Hb) у представителей семейства Channichthyidae. Эти своеобразно выглядящие рыбы были правильно названы ледяными рыбами первыми британскими китобоями и впервые были описаны физиологически в 1954 году (Ruud, 1954).
Эти своеобразно выглядящие рыбы были правильно названы ледяными рыбами первыми британскими китобоями и впервые были описаны физиологически в 1954 году (Ruud, 1954).
Ледяные рыбы — единственные известные позвоночные животные, у которых отсутствует гемоглобин во взрослом возрасте (рис.1). Кислород содержится исключительно в физическом растворе в крови ледяной рыбы, которая имеет емкость переноса кислорода <10% от того, что наблюдается у краснокровных нототениоидных рыб (Holeton, 1970). Несколько довольно драконовских модификаций сердечно-сосудистой системы ледяных рыб компенсируют отсутствие у них циркулирующего переносчика кислорода. У ледяных рыб очень большое сердце по сравнению с краснокровными рыбами такого же размера тела, в результате чего удельный вес сердечного выброса в четыре-пять раз больше, чем у краснокровных видов (Hemmingsen et al., 1972; Рис. 2). Объем крови ледяных рыб в четыре раза больше, чем у краснокровных костистых рыб, а диаметр их капилляров необычно велик (Fitch et al. , 1984). В совокупности эти особенности позволяют большому объему крови циркулировать по телу ледяной рыбы с высокой скоростью потока, но при низком сосудистом давлении из-за сниженного периферического сопротивления. В сочетании с очень высоким содержанием кислорода в антарктических водах и относительно низким абсолютным уровнем метаболизма эти необычные сердечно-сосудистые особенности обеспечивают поступление в ткани достаточного количества кислорода для поддержания облигатно-аэробного режима метаболизма этих животных (Hemmingsen, 1991).
, 1984). В совокупности эти особенности позволяют большому объему крови циркулировать по телу ледяной рыбы с высокой скоростью потока, но при низком сосудистом давлении из-за сниженного периферического сопротивления. В сочетании с очень высоким содержанием кислорода в антарктических водах и относительно низким абсолютным уровнем метаболизма эти необычные сердечно-сосудистые особенности обеспечивают поступление в ткани достаточного количества кислорода для поддержания облигатно-аэробного режима метаболизма этих животных (Hemmingsen, 1991).
Рис. 1.
Отсутствие циркулирующего гемоглобина и эритроцитов является отличительной чертой антарктических ледяных рыб. Эти две пробирки содержат свежевзятую кровь экспрессирующей гемоглобин нототениоидной рыбы ( Notothenia coriiceps ) слева и лишенной гемоглобина антарктической ледяной рыбы ( Chaenocephalus aceratus ) справа.
Рис. 1.
Отсутствие циркулирующего гемоглобина и эритроцитов является отличительной чертой антарктических ледяных рыб. Эти две пробирки содержат свежевзятую кровь экспрессирующей гемоглобин нототениоидной рыбы ( Notothenia coriiceps ) слева и лишенной гемоглобина антарктической ледяной рыбы ( Chaenocephalus aceratus ) справа.
Эти две пробирки содержат свежевзятую кровь экспрессирующей гемоглобин нототениоидной рыбы ( Notothenia coriiceps ) слева и лишенной гемоглобина антарктической ледяной рыбы ( Chaenocephalus aceratus ) справа.
Внутриклеточный белок, связывающий кислород, миоглобин (Mb), также неравномерно экспрессируется у видов семейства Channichthyidae. Миоглобин широко распространен в аэробно сбалансированных тканях животных, и ему приписывают важную роль как во внутриклеточном хранении, так и в диффузии кислорода (Wittenberg and Wittenberg, 2003).Действительно, The Journal of Experimental Biology недавно опубликовал комментарий (Ordway and Garry, 2004), название которого указывало на то, что миоглобин является «необходимым гемопротеином в поперечнополосатых мышцах». Похоже, ледяные рыбы-ханнихтии подтверждают старую поговорку о том, что из каждого правила есть исключения. Среди 16 известных видов этого семейства десять видов ледяных рыб экспрессируют Mb в своей сердечной мышце, в то время как шесть других не продуцируют этот белок (Grove et al. , 2004).
, 2004).
Очень тесное филогенетическое родство между семействами Hb-экспрессирующих и Hb-менее нототениоидных и между Mb-экспрессирующими и без Mb ледяными рыбами представляет собой уникальную матрицу «природных генетических нокаутов», которые можно использовать для исследования и понимания множества процессов. которые регулируют как доставку кислорода, так и его использование в аэробных тканях.Поскольку эти «нокауты» выдержали тесты реальной биологии, они имеют преимущества перед экспериментально полученными генетическими нокаутами для экспрессии Mb у мышей (Garry et al., 1998; Gödecke et al., 1999).
Рис. 2.
Сердца трех видов нототениоидных рыб. Ледяная рыба channichthyid Chaenocephalus aceratus имеет бледно-желтый желудочек (крайний слева) и не экспрессирует белок миоглобин (Mb).Ледяная рыба channichthyid Chionodraco rastrospinosus экспрессирует белок миоглобин и имеет розовый желудочек (в центре). Родственный нототениоидный вид Notothenia coriiceps имеет характерный красный желудочек (крайний справа), связанный с присутствием белка миоглобина. Обратите внимание, что оба сердца channichthyid значительно больше, чем у краснокровных видов, несмотря на то, что все они были вырезаны у животных с эквивалентной массой тела. (Рисунок взят из Moylan and Sidell, 2000.)
Родственный нототениоидный вид Notothenia coriiceps имеет характерный красный желудочек (крайний справа), связанный с присутствием белка миоглобина. Обратите внимание, что оба сердца channichthyid значительно больше, чем у краснокровных видов, несмотря на то, что все они были вырезаны у животных с эквивалентной массой тела. (Рисунок взят из Moylan and Sidell, 2000.)
Рис. 2.
Сердца трех видов нототениоидных рыб. Ледяная рыба channichthyid Chaenocephalus aceratus имеет бледно-желтый желудочек (крайний слева) и не экспрессирует белок миоглобин (Mb). Ледяная рыба channichthyid Chionodraco rastrospinosus экспрессирует белок миоглобин и имеет розовый желудочек (в центре). Родственный нототениоидный вид Notothenia coriiceps имеет характерный красный желудочек (крайний справа), связанный с присутствием белка миоглобина.Обратите внимание, что оба сердца channichthyid значительно больше, чем у краснокровных видов, несмотря на то, что все они были вырезаны у животных с эквивалентной массой тела. (Рисунок взят из Moylan and Sidell, 2000.)
(Рисунок взят из Moylan and Sidell, 2000.)
Характер экспрессии Hb и Mb у ледяных рыб приводит нас к ряду интригующих вопросов. Как и когда произошла потеря экспрессии этих важных белков, связывающих кислород? Имела ли потеря экспрессии гемоглобина или миоглобина адаптивное значение? Если «да», какое преимущество было предоставлено? Если «нет», то почему эти признаки сохранились в популяциях этих животных? Как появился набор физиологических характеристик, направленных, по-видимому, на компенсацию потери каждого из этих белков? Очевидно, что многие «ответы» на эти вопросы по необходимости должны находиться в сфере спекуляций.Однако недавние открытия указывают на ряд провокационных объяснений.
Поскольку бесгемоглобиновое состояние является синапоморфным для всего семейства ледяных рыб (т. е. производным или специализированным признаком, общим для двух или более групп, происходящих от их последнего общего предка), ясно, что первоначальная мутация, которая привела к удалению экспрессии Hb, произошла в или около точка расхождения ханнихтиид от их нототениоидных предков. Рууд признал, что стабильно холодные и насыщенные кислородом условия современного Южного океана, несомненно, являются экологическими характеристиками, необходимыми для выживания группы (Ruud, 1954; Ruud, 1965). Считается, что эти условия были достигнуты ок. 10–14 млн лет назад (Кеннетт, 1977). Это время согласуется с появлением большинства нототениоидных линий, которые, как считается, произошли 12–5 млн лет назад, исходя из генетических расстояний (Bargelloni et al., 2000). Эти же генетические данные позволяют предположить, что ледяные рыбы channichthyid разошлись только 5 раз.5–2 млн лет назад. К этому времени Южный океан стал стабильной и холодной средой, благоприятствующей выживанию этой группы. Несмотря на то, что они произошли от краснокровных предков, в геномной ДНК современных ледяных рыб полностью отсутствуют какие-либо обнаруживаемые остатки гена β-глобина, и она содержит только остатки гена, кодирующего α-глобин, две субъединицы которого состоят из гемоглобина (Cocca et al. и др.
Рууд признал, что стабильно холодные и насыщенные кислородом условия современного Южного океана, несомненно, являются экологическими характеристиками, необходимыми для выживания группы (Ruud, 1954; Ruud, 1965). Считается, что эти условия были достигнуты ок. 10–14 млн лет назад (Кеннетт, 1977). Это время согласуется с появлением большинства нототениоидных линий, которые, как считается, произошли 12–5 млн лет назад, исходя из генетических расстояний (Bargelloni et al., 2000). Эти же генетические данные позволяют предположить, что ледяные рыбы channichthyid разошлись только 5 раз.5–2 млн лет назад. К этому времени Южный океан стал стабильной и холодной средой, благоприятствующей выживанию этой группы. Несмотря на то, что они произошли от краснокровных предков, в геномной ДНК современных ледяных рыб полностью отсутствуют какие-либо обнаруживаемые остатки гена β-глобина, и она содержит только остатки гена, кодирующего α-глобин, две субъединицы которого состоят из гемоглобина (Cocca et al. и др. , 1995; Кокка и др., 1997).
, 1995; Кокка и др., 1997).
Характер потери Mb среди ледяных рыб channichthyid более загадочен.Нам не удалось обнаружить экспрессию Mb в окислительных скелетных мышцах ледяной рыбы или краснокровных нототениоидных видов, которые мы исследовали на сегодняшний день, что позволяет предположить, что этот фенотип даже более древний, чем отсутствие Hb (Moylan and Sidell, 2000). Белок, подобный миоглобину, был обнаружен в гликолитических скелетных мышцах ледяных рыб с помощью иммунохимических методов (Morlá et al., 2003). Это наблюдение кажется озадачивающим, учитывая, что экспрессия Mb обычно ограничивается аэробно сбалансированными окислительными мышцами и не экспрессируется в анаэробно сбалансированных гликолитических скелетных мышцах; мы не смогли воспроизвести их результаты.
Рис. 3.
Несколько независимых мутационных событий привели к потере экспрессии миоглобина (Mb) в ходе эволюции семейства ледяных рыб. Экспрессия Mb отображена на консенсусной филогении семейства Channichthyidae. Вертикальные красные полосы указывают точки независимых мутационных событий, приводящих к потере экспрессии Mb. Рисунок смоделирован после рисунка Гроува и др. (Grove et al., 2004) и основан на кладограмме, первоначально представленной Ниаром и др.(Ниар и др., 2003).
Экспрессия Mb отображена на консенсусной филогении семейства Channichthyidae. Вертикальные красные полосы указывают точки независимых мутационных событий, приводящих к потере экспрессии Mb. Рисунок смоделирован после рисунка Гроува и др. (Grove et al., 2004) и основан на кладограмме, первоначально представленной Ниаром и др.(Ниар и др., 2003).
Рис. 3.
Несколько независимых мутационных событий привели к потере экспрессии миоглобина (Mb) в ходе эволюции семейства ледяных рыб. Экспрессия Mb отображена на консенсусной филогении семейства Channichthyidae. Вертикальные красные полосы указывают точки независимых мутационных событий, приводящих к потере экспрессии Mb. Рисунок смоделирован после рисунка Гроува и др. (Grove et al., 2004) и основан на кладограмме, первоначально представленной Ниаром и др. (Ниар и др., 2003).
Как упоминалось ранее, Mb экспрессируется в желудочках сердца 10 из 16 известных видов ледяных рыб, в то время как у шести других белок отсутствует. Путем картирования потери экспрессии Mb на консенсусной филогении ледяных рыб становится ясно, что способность продуцировать Mb терялась в несколько дискретных периодов времени в ходе эволюции семейства (Fig. 3). Мы также идентифицировали как минимум три совершенно разных мутационных механизма, которые объясняют потерю экспрессии Mb в различных ветвях неэкспрессирующих клеток (таблица 1; Small et al., 1998; Смолл и др., 2003). Наиболее скупая интерпретация этого паттерна состоит в том, что Mb нефункционален при очень низкой температуре тела этих животных и его потеря по какому бы то ни было механизму может быть полезной или, в худшем случае, выборочно нейтральной (Sidell et al., 1997). Однако все имеющиеся данные указывают на отказ от этой гипотезы.
Путем картирования потери экспрессии Mb на консенсусной филогении ледяных рыб становится ясно, что способность продуцировать Mb терялась в несколько дискретных периодов времени в ходе эволюции семейства (Fig. 3). Мы также идентифицировали как минимум три совершенно разных мутационных механизма, которые объясняют потерю экспрессии Mb в различных ветвях неэкспрессирующих клеток (таблица 1; Small et al., 1998; Смолл и др., 2003). Наиболее скупая интерпретация этого паттерна состоит в том, что Mb нефункционален при очень низкой температуре тела этих животных и его потеря по какому бы то ни было механизму может быть полезной или, в худшем случае, выборочно нейтральной (Sidell et al., 1997). Однако все имеющиеся данные указывают на отказ от этой гипотезы.
Таблица 1.
Совершенно разные генетические мутации вызвали потерю экспрессии миоглобина в ходе эволюции антарктических ледяных рыб
| Виды . 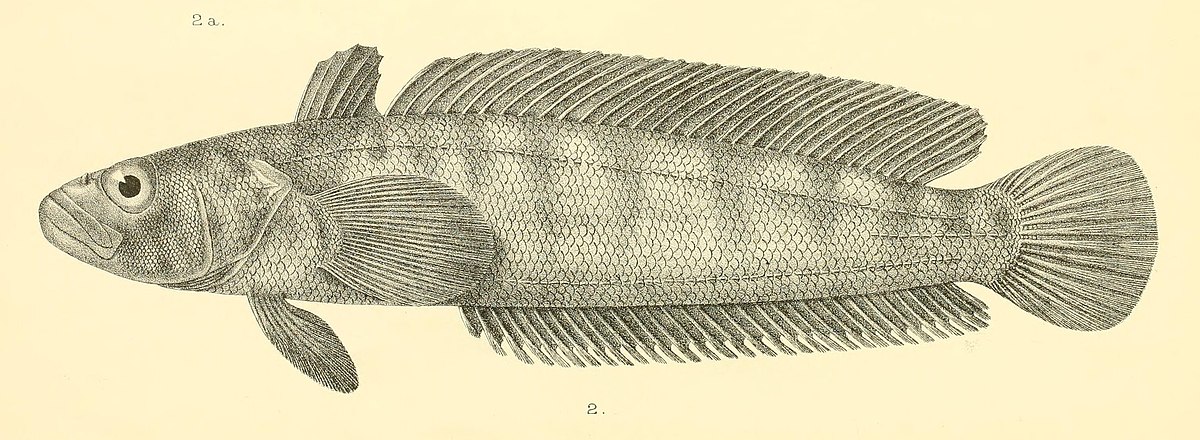 |
Характер генетического поражения (ссылка) . |
|---|---|
| Champsocephalus spp. | Вставка из 5 нуклеотидов вызывает сдвиг рамки считывания ниже а.о. 91 и преждевременную терминацию после остатка 103 (Grove et al., 2004) nt ниже стоп-кодона, может мешать эффективному полиаденилированию (Small et al., 1998) |
| Chaenocephalus aceratus | Вставка из 15 нуклеотидов, расположенная на 647 нуклеотидов выше стартового кодона, дублирует специфичный для мышц блок ТАТА и способна связывать факторы, препятствующие нормальному началу транскрипции (Small et al. .,2003) |
| Виды . |
Характер генетического поражения (ссылка) . |
|---|---|
| Champsocephalus spp. | Вставка из 5 нуклеотидов вызывает сдвиг рамки считывания ниже а.о. 91 и преждевременную терминацию после остатка 103 (Grove et al. , 2004) , 2004) |
| Chaenocephalus aceratus | box и способен связывать факторы, препятствующие нормальному запуску транскрипции (Small et al.,2003) |
Отсутствие гемоглобина и эритроцитов является настолько поразительной характеристикой, что кажется разумным предположить, что его постоянство должно давать организму некоторое адаптивное преимущество. Действительно, это было несколько оптимистичным (каламбур) предположением многих исследователей. (Такое предположение, однако, не отвечает на вопрос, почему еще большее число симпатрически встречающихся нототениоидов являются краснокровными.) Логично, что вязкость крови без гемоглобина и эритроцитов будет меньше, чем у крови типичных костистых рыб с гематокритом 25–40%. Гематокриты видов умеренной зоны снижаются в зимние месяцы (например, Powers, 1974), а у полярных рыб гематокрит обычно ниже, чем у рыб с более теплым телом (например, Scholander and Van Dam, 1957; Wells, 1990). Эти наблюдения натолкнули некоторых на мысль, что бесгемоглобиновое состояние channichthyids находится на краю общей тенденции к снижению гематокрита при низкой температуре тела (т.г. ди Приско и др., 1991). Фактически, Эггинтон сообщает, что значения гематокрита краснокровных нототениоидов в значительной степени совпадают с диапазоном значений, наблюдаемых у рыб из более теплых вод (Egginton, 1996), и что основное различие между этими группами заключается в более низкой средней концентрации гемоглобина в эритроцитах (MCHC). у краснокровных нототениоидов не ниже гематокрита. Эти аргументы дополнительно подчеркивают различные механизмы, лежащие в основе различий в экспрессии Hb между ледяными рыбами и холоднокровными, но краснокровными рыбами.Потеря экспрессии Hb у ледяных рыб является результатом массовой делеции гена. Напротив, снижение содержания Hb, которое происходит в ответ на снижение температуры у краснокровных рыб, вызвано подавлением существующего гена. Понятно, что это принципиально разные процессы.
Эти наблюдения натолкнули некоторых на мысль, что бесгемоглобиновое состояние channichthyids находится на краю общей тенденции к снижению гематокрита при низкой температуре тела (т.г. ди Приско и др., 1991). Фактически, Эггинтон сообщает, что значения гематокрита краснокровных нототениоидов в значительной степени совпадают с диапазоном значений, наблюдаемых у рыб из более теплых вод (Egginton, 1996), и что основное различие между этими группами заключается в более низкой средней концентрации гемоглобина в эритроцитах (MCHC). у краснокровных нототениоидов не ниже гематокрита. Эти аргументы дополнительно подчеркивают различные механизмы, лежащие в основе различий в экспрессии Hb между ледяными рыбами и холоднокровными, но краснокровными рыбами.Потеря экспрессии Hb у ледяных рыб является результатом массовой делеции гена. Напротив, снижение содержания Hb, которое происходит в ответ на снижение температуры у краснокровных рыб, вызвано подавлением существующего гена. Понятно, что это принципиально разные процессы. Тем не менее, многие физиологи пришли к выводу, что потеря Hb и эритроцитов у ледяных рыб приводит к энергетическому преимуществу из-за снижения внутренней вязкости крови (например, см. di Prisco et al., 1991; Чжао и др., 1998 г.; Кокка и др., 1997). Эти доводы верны только в том случае, если принять во внимание работу, необходимую для перекачивания одинакового объема крови. Однако энергетические аргументы в конечном итоге должны работать на уровне организма, и существуют огромные различия в размерах сердца, объеме крови и сердечном выбросе между нототеноидами с красной и белой кровью.
Тем не менее, многие физиологи пришли к выводу, что потеря Hb и эритроцитов у ледяных рыб приводит к энергетическому преимуществу из-за снижения внутренней вязкости крови (например, см. di Prisco et al., 1991; Чжао и др., 1998 г.; Кокка и др., 1997). Эти доводы верны только в том случае, если принять во внимание работу, необходимую для перекачивания одинакового объема крови. Однако энергетические аргументы в конечном итоге должны работать на уровне организма, и существуют огромные различия в размерах сердца, объеме крови и сердечном выбросе между нототеноидами с красной и белой кровью.
Принимая во внимание опубликованные значения среднего давления в вентральной аорте и значения сердечного выброса, нормализованные к массе тела, можно рассчитать развитие сердечной деятельности, необходимое для поддержания одинаковой массы тела рыбы как для нототениоидов, содержащих гемоглобин, так и для ледяных рыб, не содержащих гемоглобин (табл. 2).[Расчет фактической работы сердца потребует вычитания давления венозного возврата к сердцу из среднего давления в вентральной аорте. Доступно несколько оценок первого, но все согласны с тем, что давление в венозном синусе этих животных очень низкое, приближаясь к нулю. Таким образом, для сравнительных целей удельная сердечная мощность, зависящая от веса тела, является отличным показателем фактической работы сердца.] Результаты одновременно поучительны и поначалу удивительны. В среднем ледяные рыбы расходуют примерно в два раза больше сердечной энергии в единицу времени, чем краснокровные нототениоиды с эквивалентной массой тела.Хотя ледяные рыбы могут перемещать каждый мл крови с меньшими энергетическими затратами, они перекачивают гораздо больший объем в единицу времени, чтобы поддерживать эквивалентную массу тела. Этот акцент на большом объеме циркуляции у ледяных рыб побудил Тота и Гаттузо сослаться на очень большие сердца ледяных рыб в качестве примера насосов с типом I или губчатой сердечной морфологией (Tota and Gattuso, 1996), которые обеспечивают высокую пропускную способность жидкости преимущественно за счет высокого ударного объема.
2).[Расчет фактической работы сердца потребует вычитания давления венозного возврата к сердцу из среднего давления в вентральной аорте. Доступно несколько оценок первого, но все согласны с тем, что давление в венозном синусе этих животных очень низкое, приближаясь к нулю. Таким образом, для сравнительных целей удельная сердечная мощность, зависящая от веса тела, является отличным показателем фактической работы сердца.] Результаты одновременно поучительны и поначалу удивительны. В среднем ледяные рыбы расходуют примерно в два раза больше сердечной энергии в единицу времени, чем краснокровные нототениоиды с эквивалентной массой тела.Хотя ледяные рыбы могут перемещать каждый мл крови с меньшими энергетическими затратами, они перекачивают гораздо больший объем в единицу времени, чтобы поддерживать эквивалентную массу тела. Этот акцент на большом объеме циркуляции у ледяных рыб побудил Тота и Гаттузо сослаться на очень большие сердца ледяных рыб в качестве примера насосов с типом I или губчатой сердечной морфологией (Tota and Gattuso, 1996), которые обеспечивают высокую пропускную способность жидкости преимущественно за счет высокого ударного объема. , несмотря на то, что он способен достигать лишь скромных выходных давлений (ок.3 кПа). [Отличный обзор функциональной морфологии сердец рыб см. в Tota et al. (Tota et al., 1991).] Как следствие, потеря гемоглобина и эритроцитов в конечном итоге коррелирует со значительно более высоким расходом сердечной энергии на уровне организма и определенно не приводит к экономии энергии! Фактически было подсчитано, что 22% скорости метаболизма в покое у ледяных рыб приходится на работу сердца (Hemmingsen and Douglas, 1977). Таким образом, работа сердца представляет собой гораздо большую долю общих энергетических затрат у ледяных рыб, чем диапазон 0.От 5% до 5,0% общего метаболизма приходится на рыб умеренной зоны и 2,3% общего метаболизма даже на таких спортивных рыб, как полосатый тунец (Farrell and Jones, 1992). В отличие от сердца ледяной рыбы, сердце тунца было приведено в качестве яркого примера насоса, подобного млекопитающим, обладающего хорошо развитым компактным эпикардом и преимущественно зависящего от развития давления для повышения сердечной работы (Tota and Gattuso, 1996).
, несмотря на то, что он способен достигать лишь скромных выходных давлений (ок.3 кПа). [Отличный обзор функциональной морфологии сердец рыб см. в Tota et al. (Tota et al., 1991).] Как следствие, потеря гемоглобина и эритроцитов в конечном итоге коррелирует со значительно более высоким расходом сердечной энергии на уровне организма и определенно не приводит к экономии энергии! Фактически было подсчитано, что 22% скорости метаболизма в покое у ледяных рыб приходится на работу сердца (Hemmingsen and Douglas, 1977). Таким образом, работа сердца представляет собой гораздо большую долю общих энергетических затрат у ледяных рыб, чем диапазон 0.От 5% до 5,0% общего метаболизма приходится на рыб умеренной зоны и 2,3% общего метаболизма даже на таких спортивных рыб, как полосатый тунец (Farrell and Jones, 1992). В отличие от сердца ледяной рыбы, сердце тунца было приведено в качестве яркого примера насоса, подобного млекопитающим, обладающего хорошо развитым компактным эпикардом и преимущественно зависящего от развития давления для повышения сердечной работы (Tota and Gattuso, 1996). В свете этих энергичных соображений и довольно резких компенсаторных изменений сердечно-сосудистой анатомии и физиологии, наблюдаемых у ледяных рыб, кажется разумным заключить, как предполагалось первоначально (Wells, 1990), что потеря гемоглобина и эритроцитов не давала адаптивных преимуществ рыбе. чаннихтиды.
В свете этих энергичных соображений и довольно резких компенсаторных изменений сердечно-сосудистой анатомии и физиологии, наблюдаемых у ледяных рыб, кажется разумным заключить, как предполагалось первоначально (Wells, 1990), что потеря гемоглобина и эритроцитов не давала адаптивных преимуществ рыбе. чаннихтиды.
Таблица 2.
Потеря экспрессии гемоглобина энергетически невыгодна †
| Виды . |
Экспрессия гемоглобина . |
Сердечный выброс (мл кг -1 мин -1 ) . |
Вентральное аортальное давление (кПа) . |
Развитие сердечной деятельности (мВт кг -1 ) . |
|
|---|---|---|---|---|---|
| Trematomus bernacchii | + | 17,6 | 3,09 | 0,905 | |
| Pagothenia borchgrevinki | + | 29,6 | 3. 60 60 |
1.76 | 1,76 |
| псевдочаэничТини Груза B | – | 80,5 | 1.87 | 2.51 | 291 |
| ChaenoCephalus Aceratus | – | 77.0 | 2.30 | 2.94 |
| Вид . |
Экспрессия гемоглобина . |
Сердечный выброс (мл кг -1 мин -1 ) . |
Вентральное аортальное давление (кПа) . |
Развитие сердечной деятельности (мВт кг -1 ) . |
|
|---|---|---|---|---|---|
| Trematomus bernacchii | + | 17,6 | 3,09 | 0,905 | |
| Pagothenia borchgrevinki | + | 29,6 | 3. 60 60 |
1.76 | 1,76 |
| псевдочаэничТини Груза B | – | 80,5 | 1.87 | 2.51 | 291 |
| ChaenoCephalus Aceratus | – | 77,0 | 230 | 2.94 |
Многочисленные случаи потери Mb, наблюдаемые у ледяных рыб, вызывают еще большее недоумение. Это становится особенно очевидным, если учесть, что каждая клада, характеризующаяся отсутствием экспрессии Mb, более тесно связана с кладами, которые продуцируют белок, чем с теми, которые этого не делают (ср.рис. 3). Таким образом, способность продуцировать Mb была утрачена в результате нескольких совершенно независимых мутационных событий. Этот паттерн предполагает, что Mb может быть «рудиментарным» белком, который может плохо работать при очень низкой температуре тела ледяных рыб. Мы провели несколько независимых исследований, чтобы оценить эту возможность.
Мы провели несколько независимых исследований, чтобы оценить эту возможность.
Мы использовали спектроскопию с остановленным потоком, чтобы установить, что кислород связывается и диссоциирует от Mb ледяной рыбы быстрее, чем от Mb млекопитающих при всех температурах (Cashon et al., 1997). Однако при сравнении измерений при соответствующих физиологических температурах Mbs этих двух групп демонстрируют очень сходную кинетику связывания и диссоциации. Короче говоря, Mb ледяной рыбы функционирует при 0°C так же, как Mb млекопитающих при 37°C. Наши результаты также показали, что низкотемпературная функция Mb характерна не только для ледяных рыб, но и для других костистых рыб. Повышенная активность Mbs костистых костей при низких температурах, по-видимому, связана с заменой обычной D-спирали, обнаруженной у Mbs млекопитающих, на random-coil.Эта замена, несомненно, придает белку большую конформационную гибкость, усиливая вход и выход кислорода из кармана связывания гема (Cashon et al. , 1997). Таким образом, кинетика связывания кислорода демонстрирует, что Mb ледяной рыбы функционирует при низкой температуре.
, 1997). Таким образом, кинетика связывания кислорода демонстрирует, что Mb ледяной рыбы функционирует при низкой температуре.
Еще более убедительные доказательства функции Mb у ледяных рыб были получены в исследованиях изолированного перфузируемого сердца (Acierno et al., 1997). Сердца видов ледяных рыб, содержащих Mb, могут поддерживать сердечный выброс при более высоком давлении постнагрузки, чем сердца близкородственных видов, у которых отсутствует Mb (рис.4). Кроме того, мы смогли доказать, что эти различия в работе сердца были однозначно связаны с присутствием или отсутствием миоглобина, используя нитрит натрия, селективный яд Mb с функцией связывания кислорода. При включении в перфузат 5 ммоль л –1 NaNO 2 механические характеристики сердец тех видов, которые экспрессируют белок, значительно ухудшаются, в то время как те, у которых от природы отсутствует белок, невосприимчивы к такой обработке (рис. 4). Неожиданным результатом этих экспериментов, однако, было то, что сердца, которые естественным образом лишены Mb, функционировали лучше, чем сердца, экспрессирующие Mb, в которых функция белка была удалена химически.Этот результат предполагает, что физиологические особенности развились для компенсации недостатка Mb в тех сердцах, которые в норме не экспрессируют этот белок. Несколько линий доказательств указывают на то, что NaNO 2 является специфическим ингибитором Mb и не высвобождает NO в перфузат, что могло бы исказить эти выводы. Этот момент очень важен, потому что оксид азота может влиять на сердечную функцию несколькими способами. Во-первых, в высоких концентрациях NO ингибирует активность цитохром с оксидазы (ЦОГ) (Antunes et al., 2004). В экспериментах этого не наблюдается. Ранее мы показали, что активность оксидазы цитохрома с на г желудочковой ткани эквивалентна между С. aceratus и С. rastrospinosus (O’Brien and Sidell, 2000).
4). Неожиданным результатом этих экспериментов, однако, было то, что сердца, которые естественным образом лишены Mb, функционировали лучше, чем сердца, экспрессирующие Mb, в которых функция белка была удалена химически.Этот результат предполагает, что физиологические особенности развились для компенсации недостатка Mb в тех сердцах, которые в норме не экспрессируют этот белок. Несколько линий доказательств указывают на то, что NaNO 2 является специфическим ингибитором Mb и не высвобождает NO в перфузат, что могло бы исказить эти выводы. Этот момент очень важен, потому что оксид азота может влиять на сердечную функцию несколькими способами. Во-первых, в высоких концентрациях NO ингибирует активность цитохром с оксидазы (ЦОГ) (Antunes et al., 2004). В экспериментах этого не наблюдается. Ранее мы показали, что активность оксидазы цитохрома с на г желудочковой ткани эквивалентна между С. aceratus и С. rastrospinosus (O’Brien and Sidell, 2000). Таким образом, если NO присутствует на уровне, достаточном для ингибирования цитохромоксидазы, он должен ингибировать активность ЦОГ в одинаковой степени в сердцах обоих видов. Это явно не так; сердца от C. aceratus не поддаются лечению NaNO 2 , тогда как сердечный выброс в сердцах от C.rastrospinosus значительно снижается. Во-вторых, NO оказывает положительное инотропное действие на сердце ледяной рыбы (Pellegrino et al., 2004). Таким образом, если бы NO высвобождался из NaNO 2 , можно было бы ожидать увеличение сердечного выброса, особенно в сердцах C. aceratus , лишенных Mb, а не уменьшение, как это наблюдалось в сердцах C. rastrospinosus . .
Рис. 4.
Миоглобин улучшает работу сердца ледяной рыбы.Сердечный выброс измеряли в сердцах Chionodraco rastrospinosus , содержащих Mb, и Chaenocephalus aceratus , не содержащих Mb, в присущих им ритмах. Постнагрузка, против которой перекачивался перфузат сердца, постепенно увеличивалась, чтобы описать ухудшение работы сердца как функцию нагрузки давлением. (A) При перекачивании оксигенированного раствора Рингера сердца, содержащие Mb (Mb+, заштрихованные кружки), были способны поддерживать сердечный выброс при более серьезных нагрузках после нагрузки, чем сердца, не содержащие Mb (Mb–, незаштрихованные кружки).(B) Когда 5 ммоль л –1 NaNO 2 , который избирательно отравляет функцию Mb, вводили в перфузат, механические характеристики сердец, содержащих Mb, снижались настолько резко, что они уступали сердцам, лишенным Mb, которые были резистентны к лечению. (Адаптировано из Acierno et al., 1997.)
Постнагрузка, против которой перекачивался перфузат сердца, постепенно увеличивалась, чтобы описать ухудшение работы сердца как функцию нагрузки давлением. (A) При перекачивании оксигенированного раствора Рингера сердца, содержащие Mb (Mb+, заштрихованные кружки), были способны поддерживать сердечный выброс при более серьезных нагрузках после нагрузки, чем сердца, не содержащие Mb (Mb–, незаштрихованные кружки).(B) Когда 5 ммоль л –1 NaNO 2 , который избирательно отравляет функцию Mb, вводили в перфузат, механические характеристики сердец, содержащих Mb, снижались настолько резко, что они уступали сердцам, лишенным Mb, которые были резистентны к лечению. (Адаптировано из Acierno et al., 1997.)
Рис. 4.
Миоглобин улучшает работу сердца ледяной рыбы. Сердечный выброс измеряли в сердцах Chionodraco rastrospinosus , содержащих Mb, и Chaenocephalus aceratus , не содержащих Mb, в присущих им ритмах.Постнагрузка, против которой перекачивался перфузат сердца, постепенно увеличивалась, чтобы описать ухудшение работы сердца как функцию нагрузки давлением. (A) При перекачивании оксигенированного раствора Рингера сердца, содержащие Mb (Mb+, заштрихованные кружки), были способны поддерживать сердечный выброс при более высоких нагрузках после нагрузки, чем сердца, не содержащие Mb (Mb–, незаштрихованные кружки). (B) При 5 ммоль л –1 NaNO 2 , который избирательно отравляет функцию Mb, был включен в перфузат, механические характеристики сердец, содержащих Mb, снижались настолько резко, что они уступали сердцам без Mb, которые были устойчивы к лечению.(Адаптировано из Acierno et al., 1997.)
(A) При перекачивании оксигенированного раствора Рингера сердца, содержащие Mb (Mb+, заштрихованные кружки), были способны поддерживать сердечный выброс при более высоких нагрузках после нагрузки, чем сердца, не содержащие Mb (Mb–, незаштрихованные кружки). (B) При 5 ммоль л –1 NaNO 2 , который избирательно отравляет функцию Mb, был включен в перфузат, механические характеристики сердец, содержащих Mb, снижались настолько резко, что они уступали сердцам без Mb, которые были устойчивы к лечению.(Адаптировано из Acierno et al., 1997.)
Все данные, приведенные выше, убедительно указывают на то, что потеря способности экспрессировать Hb и Mb не была полезной. Действительно, доступная информация ясно указывает на то, что каждая из этих потерь должна была привести к ухудшению физиологических показателей рыб. Согласно номенклатуре Баума и Ларсена, обе эти черты можно было бы квалифицировать как «дезаптации» (Baum and Larsen, 1991). Действительно, многократные потери миоглобина во время эволюции ледяных рыб были названы ярким примером дезадаптации среди антарктических рыб (Montgomery and Clements, 2000). Такой вывод противоречит современной эволюционной теории, которая предполагает, что селективное давление должно приводить к сохранению экспрессии Hb и Mb, а мутации, вызывающие их потерю, должны подвергаться отрицательному отбору и исключаться из популяции. Независимо от конкретной номенклатуры, используемой для их описания, сохранение этих признаков кажется загадкой.
Действительно, многократные потери миоглобина во время эволюции ледяных рыб были названы ярким примером дезадаптации среди антарктических рыб (Montgomery and Clements, 2000). Такой вывод противоречит современной эволюционной теории, которая предполагает, что селективное давление должно приводить к сохранению экспрессии Hb и Mb, а мутации, вызывающие их потерю, должны подвергаться отрицательному отбору и исключаться из популяции. Независимо от конкретной номенклатуры, используемой для их описания, сохранение этих признаков кажется загадкой.
Как и практически все подобные эволюционные вопросы, нет никакого способа получить окончательный ответ на поставленный выше вопрос. Однако изобилие и очевидный успех ледяных рыб в Южном океане заставляют нас, по крайней мере, подумать о возможном объяснении. Для этого мы должны систематизировать информацию из таких разных областей, как геология, климатология, океанография и биология. В совокупности эти особенности подчеркивают поистине уникальный набор условий, в которых развивались нототениоидные рыбы Антарктиды.
В совокупности эти особенности подчеркивают поистине уникальный набор условий, в которых развивались нототениоидные рыбы Антарктиды.
Как экологические, так и физиологические характеристики помогают объяснить, почему потери Hb и Mb не смертельны на уровне отдельного организма. Мы видели, что очень низкая температура и интенсивное вертикальное перемешивание Южного океана приводят к высокому насыщению кислородом воды. Кроме того, абсолютная скорость метаболизма антарктических рыб относительно низка из-за низкой температуры тела и их умеренной двигательной активности в результате их происхождения от общего вялого демерсального предка.Конвергенция этих особенностей, вероятно, обеспечивала достаточную оксигенацию тканей для поддержания жизни у ранних channichthyids, несмотря на потерю белков, связывающих кислород. Несмотря на объяснение того, почему потеря кислород-связывающих белков могла не быть летальной, эта линия рассуждений все же не отвечает на более сложный вопрос, почему такие явно «неблагоприятные» черты сохранялись на популяционном уровне.
Важно помнить, что если признак сублетальный, то он “неудобен” только в контексте конкуренции с другими организмами.Другими словами, если конкуренция достаточно ослаблена, а ресурсы окружающей среды (например, калорийность) не ограничены, сублетальные признаки могут не оказывать реального влияния на приспособленность организмов. Необычная история эволюции антарктической ихтиофауны предполагает, что они могли распространяться в условиях незначительной конкуренции ниш или ее отсутствия. Массовое сокращение видового разнообразия среди рыб в Южном океане, произошедшее между серединой третичного периода и настоящим временем, привело к тому, что предковый запас демерсальных нототениоидов колонизировал примерно 10% объема мирового океана.Преобладает мнение, что это событие объясняет окончательное доминирование нототениоидных видов в антарктических морях (Eastman, 1993).
Последняя часть головоломки связана с признанием того, что климатическое похолодание Антарктиды в течение последних 25 млн лет не было гладко монотонным. Действительно, существуют данные, свидетельствующие о том, что глубокие (>100 м) незамерзающие морские заливы формировались во время периодических отступлений ледникового щита континента несколько раз даже в течение последних 5 млн лет (т.г. см. Уэбб, 1990). Периодическая доступность этих глубоких фьордов для колонизации редко встречающимися нототениоидами обеспечивает последний ингредиент убежищ, который, возможно, способствовал как исключительно быстрой радиации нототениоидных видов в целом, так и закреплению необычных признаков отсутствия Hb и Mb у некоторых видов. виды ледяных рыб.
Действительно, существуют данные, свидетельствующие о том, что глубокие (>100 м) незамерзающие морские заливы формировались во время периодических отступлений ледникового щита континента несколько раз даже в течение последних 5 млн лет (т.г. см. Уэбб, 1990). Периодическая доступность этих глубоких фьордов для колонизации редко встречающимися нототениоидами обеспечивает последний ингредиент убежищ, который, возможно, способствовал как исключительно быстрой радиации нототениоидных видов в целом, так и закреплению необычных признаков отсутствия Hb и Mb у некоторых видов. виды ледяных рыб.
Мы сравнили особенности строения сердца трех видов антарктических нототениоидных рыб, различающихся по экспрессии кислородсвязывающих белков: Gobionotothen gibberifrons (краснокровный вид, сердце которого также содержит Mb), Chionodraco rastrospinosus (Hb- отсутствует ледяная рыба, экспрессирующая Mb в сердце) и Chaenocephalus aceratus (ледяная рыба, не содержащая Hb и Mb). На тканевом уровне мы обнаружили, что сердце обеих ледяных рыб, лишенных гемоглобина, было более губчатым (т. е. среднее диффузионное расстояние, которое кислород должен был бы пройти между люменальной кровью и тканью, было короче), чем сердца краснокровных видов (O ‘Brien et al., 2000) (таблица 3). Сердца как экспрессирующих Mb, так и не имеющих Mb ледяных рыб, однако, не обнаруживают существенных различий в этом признаке. Похоже, что сердца ледяных рыб развили более распространенную систему заполненных кровью лакун в их губчатом миокарде, чтобы обеспечить адекватную доставку кислорода из их сравнительно дефицитной по кислороду крови.
На тканевом уровне мы обнаружили, что сердце обеих ледяных рыб, лишенных гемоглобина, было более губчатым (т. е. среднее диффузионное расстояние, которое кислород должен был бы пройти между люменальной кровью и тканью, было короче), чем сердца краснокровных видов (O ‘Brien et al., 2000) (таблица 3). Сердца как экспрессирующих Mb, так и не имеющих Mb ледяных рыб, однако, не обнаруживают существенных различий в этом признаке. Похоже, что сердца ледяных рыб развили более распространенную систему заполненных кровью лакун в их губчатом миокарде, чтобы обеспечить адекватную доставку кислорода из их сравнительно дефицитной по кислороду крови.
Таблица 3.
Структурные и ультраструктурные особенности сердечной мышцы антарктических нототениоидных рыб
| Виды . |
ГБ/МБ . |
O 2 расстояние диффузии через ткань (мкм) a .  |
Объемная плотность митохондрий [ V v,mit , f %)] b . |
||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ОоЫопоШНеп gibberifrons | + / + | 9,82 ± 1,37 | 15,87 ± 0,74 | ||||||||||
| шипоносая белокровка | – / + | 6,20 ± 0,86 | 20,10 ± 0,74 | ГБ/МБ . |
O 2 расстояние диффузии через ткань (мкм) a . |
Объемная плотность митохондрий [ V v,mit , f %)] b . |
|||||||
| GOBIONOTOTHEN Gibberifrons |
+ / + |
9.82 ± 1,37 |
15.87 ± 0,74 |
Chionodraco Rastrospinosus |
– / + |
6.20 ± 0,86 |
20.10 ± 0,74
| | Chaenocephalus Aceratus |
– / – |
6. |
 23 ± 0,41 23 ± 0,41 36,53 ± 2.07 |
|
На уровне тонкой клеточной структуры плотность митохондрий в окислительных мышцах антарктических рыб также коррелирует с наличием или отсутствием Hb и Mb (O’Brien and Sidell, 2000). Митхондрии (1) составляют примерно 16% объема клеток в сердце краснокровных Gobionotothen gibberifrons , которые также содержат Mb; (2) составляют ~20% объема клеток кардиомиоцитов Chionodraco rastrospinosus , которые лишены Hb, но экспрессируют Mb, и (3) вытесняют ~36% объема клеток кардиомиоцитов Chaenocephalus aceratus, , которые лишены как Hb, так и Mb (таблица 3; O’Brien and Sidell, 2000).Таким образом, потеря гемоглобина приводит лишь к умеренному (∼4%) увеличению популяции митохондрий в сердечной мышце до тех пор, пока ткань продолжает экспрессировать Mb. Однако, когда и Hb, и Mb отсутствуют, расширение митохондриальной популяции является драматическим (то есть дальнейшее увеличение объема клетки на 16%). Удивительно, но высокая плотность митохондрий в сердце рыб, лишенных Hb и Mb, не увеличивает аэробную метаболическую способность. Фактически, активность аэробно сбалансированных ферментов (на 1 г ткани сердца), таких как цитохромоксидаза и цитратсинтаза, одинакова у всех трех видов, несмотря на существенные различия в количестве митохондрий.Высокая плотность увеличенных митохондрий у ледяных рыб, лишенных Hb и Mb, приводит к образованию переплетенной сети мембран. Эта липидная магистраль, вероятно, служит важным путем для кислорода, усиливая его доставку в отсутствие белков, связывающих кислород (Sidell, 1998).
Удивительно, но высокая плотность митохондрий в сердце рыб, лишенных Hb и Mb, не увеличивает аэробную метаболическую способность. Фактически, активность аэробно сбалансированных ферментов (на 1 г ткани сердца), таких как цитохромоксидаза и цитратсинтаза, одинакова у всех трех видов, несмотря на существенные различия в количестве митохондрий.Высокая плотность увеличенных митохондрий у ледяных рыб, лишенных Hb и Mb, приводит к образованию переплетенной сети мембран. Эта липидная магистраль, вероятно, служит важным путем для кислорода, усиливая его доставку в отсутствие белков, связывающих кислород (Sidell, 1998).
Набор анатомических и физиологических характеристик ледяных рыб, которые, по-видимому, связаны с потерей экспрессии Hb и Mb, обширен.Как же тогда эти явно адаптивные черты могли развиться в условиях ослабленной конкуренции? Одна из возможностей заключается в том, что потеря Hb и Mb вызвала немедленные улучшающие изменения в физиологии ледяной рыбы, которые со временем стали фиксированными чертами. Другими словами, первоначальная потеря Hb и Mb ускоряла развитие вторичных сердечно-сосудистых признаков. Эта идея подтверждается недавними исследованиями, освещающими новую роль Hb и Mb в метаболизме мощной сигнальной молекулы, оксида азота.
Другими словами, первоначальная потеря Hb и Mb ускоряла развитие вторичных сердечно-сосудистых признаков. Эта идея подтверждается недавними исследованиями, освещающими новую роль Hb и Mb в метаболизме мощной сигнальной молекулы, оксида азота.
Физиологи-рыбоведы, изучающие ханниктиевых ледяных рыб, до сих пор сосредоточивались на вопросах, связанных с экономией доставки и потребления кислорода. По логике вещей, это были наиболее актуальные и первоочередные проблемы, требующие решения, учитывая наше понимание гемоглобина и миоглобина как важнейших запасающих и транспортных белков кислорода. Однако недавние исследования эволюции глобиновых белков выявили дополнительную функцию этих белков.Теперь мы знаем, что гемоглобины позвоночных происходят из более примитивных глобинов бактерий, нематод и дрожжей, которые метаболизируют оксид азота (NO) (Liu et al., 2000; Minning et al., 1999; Gardner et al. , 1998). . Эти предковые глобины функционируют как NO-оксигеназы, используя кислород для превращения NO в нитраты. Исследования Hb-NO-оксигеназной активности в одноклеточных организмах послужили основой для более поздней работы с гемоглобинами позвоночных, которая показала, что в дополнение к связыванию кислорода как Hb, так и Mb также расщепляют NO до нитрата (Gardner, 2005; Flögel et al., 2001). Более того, эта функция является неотъемлемой частью физиологии животного. Отсутствие Mb у широко изученных мышей без миоглобина приводит к повышенной чувствительности к NO и активации нижестоящих путей, регулируемых NO (Flögel et al., 2001; Grange et al., 2001).
, 1998). . Эти предковые глобины функционируют как NO-оксигеназы, используя кислород для превращения NO в нитраты. Исследования Hb-NO-оксигеназной активности в одноклеточных организмах послужили основой для более поздней работы с гемоглобинами позвоночных, которая показала, что в дополнение к связыванию кислорода как Hb, так и Mb также расщепляют NO до нитрата (Gardner, 2005; Flögel et al., 2001). Более того, эта функция является неотъемлемой частью физиологии животного. Отсутствие Mb у широко изученных мышей без миоглобина приводит к повышенной чувствительности к NO и активации нижестоящих путей, регулируемых NO (Flögel et al., 2001; Grange et al., 2001).
Эти результаты побуждают нас расширить спектр наших вопросов, связанных с физиологией ледяной рыбы, и спросить: Каковы потенциальные последствия потери Hb и Mb в качестве NO-оксигеназ? Ответы заманчивы и предполагают, что потеря активности NO-оксигеназы и последующее повышение уровня NO могут объяснить многие, если не все, уникальные сердечно-сосудистые и физиологические особенности, которые развились у ледяных рыб.
NO представляет собой небольшую молекулу с высокой способностью к диффузии, которая регулирует широкий спектр физиологических процессов (обзор Kerwin, Jr et al., 1995). У высших позвоночных NO является продуктом реакции, катализируемой тремя различными изоформами фермента синтазы оксида азота (NOS; КФ 1.14.13.39): эндотелиальной NOS (eNOS, NOS-III), нейрональной NOS (nNOS, ncNOS, NOS- I) и индуцируемых NOS (iNOS, mNOS, NOS-II). Все изоформы NOS катализируют 5-электронное окисление аргинина с образованием NO и l-цитруллина с использованием NADPH в качестве источника электронов (Moncada and Higgs, 1993).Две изоформы, eNOS и nNOS, конститутивно экспрессируются у млекопитающих, в то время как iNOS индуцируется цитокинами и другими стимулами, включая гипоксию (Kerwin, Jr et al., 1995). Однако даже конститутивно экспрессируемые изоформы NOS активируются в ответ на физиологические стимулы, такие как гипоксия и гемодинамический сдвиговой стресс (Shaul, 2002).
В рыбе присутствуют все три изоформы NOS. Сообщалось об эндотелиальной NOS (eNOS) в эндотелии сосудов и сердечной мышце развивающихся рыбок данио (Fritsche et al., 2000), а присутствие nNOS и iNOS четко установлено в различных тканях нескольких видов рыб (например, Holmqvist et al., 1998; Holmqvist et al., 2004; Morlá et al., 2003, Pellegrino et al. ., 2002; Пеллегрино и др., 2004). Недавнее исследование показывает, что nNOS экспрессируется на более высоком уровне в скелетных мышцах ледяных рыб, чем в тканях краснокровных видов (Morlá et al., 2003). И eNOS, и iNOS были идентифицированы в желудочковых кардиомиоцитах белых и краснокровных нототениод, а eNOS также обнаружена в эндотелии и эпикарде желудочков сердца этих рыб (Tota et al., 2005). Было показано, что NO регулирует сердечно-сосудистую деятельность у ледяных рыб, включая расширение жаберных сосудов, ударный объем сердца и выходную мощность (Pellegrino et al. , 2003). Интересно, что NO оказывает положительный инотропный эффект на сердечно-сосудистую функцию ледяной рыбы, тогда как у других рыб и млекопитающих NO оказывает отрицательный инотропный эффект (Tota et al., 2005). На данный момент неизвестно, связано ли это различие с отсутствием гемоглобина или с каким-то другим видоспецифическим различием в экспрессии сигнальных молекул, действующих ниже NO.Несмотря на это, кажется вероятным, что если NO присутствует в достаточных количествах для контроля этих процессов, то он, вероятно, также способствует регуляции дополнительных функций сердечно-сосудистой и мышечной систем.
, 2003). Интересно, что NO оказывает положительный инотропный эффект на сердечно-сосудистую функцию ледяной рыбы, тогда как у других рыб и млекопитающих NO оказывает отрицательный инотропный эффект (Tota et al., 2005). На данный момент неизвестно, связано ли это различие с отсутствием гемоглобина или с каким-то другим видоспецифическим различием в экспрессии сигнальных молекул, действующих ниже NO.Несмотря на это, кажется вероятным, что если NO присутствует в достаточных количествах для контроля этих процессов, то он, вероятно, также способствует регуляции дополнительных функций сердечно-сосудистой и мышечной систем.
Только за последние пару лет мы узнали, что еще одна очень важная роль NO заключается в стимуляции и поддержании высокой плотности митохондрий в различных тканях (Nisoli et al., 2003; Нисоли и др., 2004). NO индуцирует митохондриальный биогенез через гуанилатциклазу и цГМФ-зависимый путь (рис. 6). Он также играет роль в поддержании конститутивных уровней плотности митохондрий. Нуль-мутантные мыши, лишенные eNOS, имеют более низкие уровни мтДНК, а также уровни мРНК субъединицы IV цитохромоксидазы (COXIV) и цитохрома c по сравнению с мышами дикого типа в тканях мозга, печени и сердца (Nisoli et al. др., 2003).
6). Он также играет роль в поддержании конститутивных уровней плотности митохондрий. Нуль-мутантные мыши, лишенные eNOS, имеют более низкие уровни мтДНК, а также уровни мРНК субъединицы IV цитохромоксидазы (COXIV) и цитохрома c по сравнению с мышами дикого типа в тканях мозга, печени и сердца (Nisoli et al. др., 2003).
Рис.6.
Оксид азота (NO) регулирует многие физиологические процессы, характерные для ледяной рыбы. NO стимулирует ангиогенез посредством активации фактора роста эндотелия сосудов (VEGF). Митохондриальный биогенез индуцируется NO через коактиватор 1α рецептора, активируемого пролифератором пероксисом (PGC-1). Также было показано, что NO вызывает гипертрофию мышц, хотя этот молекулярный путь еще предстоит определить. Авторы признают использование Sciencesslides (Visiscience Corp.) при создании этой фигуры.
Рис. 6.
Оксид азота (NO) регулирует многие физиологические процессы, характерные для ледяной рыбы. NO стимулирует ангиогенез посредством активации фактора роста эндотелия сосудов (VEGF). Митохондриальный биогенез индуцируется NO через коактиватор 1α рецептора, активируемого пролифератором пероксисом (PGC-1). Также было показано, что NO вызывает гипертрофию мышц, хотя этот молекулярный путь еще предстоит определить. Авторы признают использование Sciencesslides (Visiscience Corp.) при создании этой фигуры.
NO стимулирует ангиогенез посредством активации фактора роста эндотелия сосудов (VEGF). Митохондриальный биогенез индуцируется NO через коактиватор 1α рецептора, активируемого пролифератором пероксисом (PGC-1). Также было показано, что NO вызывает гипертрофию мышц, хотя этот молекулярный путь еще предстоит определить. Авторы признают использование Sciencesslides (Visiscience Corp.) при создании этой фигуры.
Оксид азота активирует митохондриальный биогенез через коактиватор транскрипции, коактиватор γ-активируемого пролифератором пероксисом γ-коактиватора 1α (PGC-1α) (Wu et al., 1999). PGC-1α является членом семейства коактиваторов транскрипции PPARγ, которые модулируют активность факторов транскрипции посредством белок-белковых взаимодействий с факторами транскрипции, белками с активностью гистон-ацетилтрансферазы и белками процессинга РНК (рассмотрено в Puigserver and Spiegelman, 2003). .PGC-1α стимулирует и модулирует экспрессию двух ядерных факторов транскрипции, ядерных респираторных факторов 1 и 2 (NRF-1, -2) (Wu et al., 1999). Вместе эти транскрипционные факторы регулируют экспрессию ряда ядерно-кодируемых митохондриальных генов, включая цитохром c , субъединицы как АТФ-синтазы, так и цитохром c оксидазы, а также ферментов биосинтеза гема (Scarpulla, 1997). NRF также индуцируют экспрессию митохондриального транскрипционного фактора-А (mtTFA), который транслоцируется в митохондрию и контролирует транскрипцию мтДНК (Shadel and Clayton, 1993; Wu et al., 1999). Вместе эти факторы координируют активацию генов, необходимых для митохондриального биогенеза.
.PGC-1α стимулирует и модулирует экспрессию двух ядерных факторов транскрипции, ядерных респираторных факторов 1 и 2 (NRF-1, -2) (Wu et al., 1999). Вместе эти транскрипционные факторы регулируют экспрессию ряда ядерно-кодируемых митохондриальных генов, включая цитохром c , субъединицы как АТФ-синтазы, так и цитохром c оксидазы, а также ферментов биосинтеза гема (Scarpulla, 1997). NRF также индуцируют экспрессию митохондриального транскрипционного фактора-А (mtTFA), который транслоцируется в митохондрию и контролирует транскрипцию мтДНК (Shadel and Clayton, 1993; Wu et al., 1999). Вместе эти факторы координируют активацию генов, необходимых для митохондриального биогенеза.
Высокие уровни NO могут вызывать гипертрофию сердца у животных с дефицитом миоглобина. Индекс массы сердца к массе тела увеличивается на 33% у мышей без миоглобина со сверхэкспрессией iNOS по сравнению с животными дикого типа (Gödecke et al.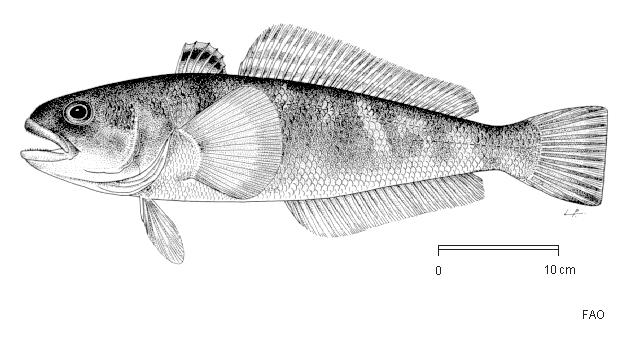 , 2003). Детали пути, регулирующего эти изменения, неизвестны.
, 2003). Детали пути, регулирующего эти изменения, неизвестны.
Оксид азота также вызывает гипертрофию мышц и активирует сателлитные клетки в скелетных мышцах млекопитающих (Smith et al., 2002; Anderson, 2000). Нейрональная синтаза оксида азота является частью белково-гликопротеинового комплекса дистрофина, который связывает актин с компонентами базальной мембраны. Нейрональная NOS активируется как механической силой, так и давлением. Последующая продукция NO индуцирует экспрессию двух белков цитоскелета, талина и винкулина, что приводит к мышечной гипертрофии (Tidball et al., 1999). NO, продуцируемый nNOS, также активирует сателлитные клетки мышц, хотя молекулярные компоненты этого пути неизвестны (Anderson, 2000).
Очевидно, что оксид азота является важной сигнальной молекулой, которая регулирует множество биологических процессов. Многие из них являются фенотипическими характеристиками, которые долгое время ассоциировались с ледяными рыбами. Традиционно мы думали, что эти характеристики эволюционировали с течением времени исключительно из-за селективного давления во время радиации семейства Channichthyidae.Однако недавнее открытие роли белков глобина в метаболизме NO позволяет предположить, что эти характеристики могли впервые появиться как прямой результат потери экспрессии Hb и Mb.
Многие из них являются фенотипическими характеристиками, которые долгое время ассоциировались с ледяными рыбами. Традиционно мы думали, что эти характеристики эволюционировали с течением времени исключительно из-за селективного давления во время радиации семейства Channichthyidae.Однако недавнее открытие роли белков глобина в метаболизме NO позволяет предположить, что эти характеристики могли впервые появиться как прямой результат потери экспрессии Hb и Mb.
Когда в ходе эволюции ледяной рыбы произошли мутации, приводящие к потере экспрессии Hb и Mb, первичные пути деградации NO были устранены. NO, конститутивно продуцируемый системой NOS у этих животных, имел бы гораздо более длительный биологический период полураспада, и конечным результатом должно было бы стать повышение устойчивых уровней NO в тканях ледяной рыбы по сравнению с уровнями экспрессирующих Hb и Mb.Фактически, предварительные данные свидетельствуют о том, что циркулирующие уровни NO у ледяной рыбы более чем в 2 раза выше, чем у краснокровных нототениоидов (B. D.S., неопубликовано). Мы можем предсказать, что повышенные уровни NO приведут практически ко всем характерным признакам, которые мы описали для ледяных рыб. Повышенная плотность сосудов в ткани сетчатки и увеличенный диаметр просвета кровеносных сосудов в окислительных мышцах ледяных рыб согласуются с заметной активацией ангиогенных процессов, которую можно было бы ожидать в ответ на постоянно более высокие уровни NO.Точно так же повышенная плотность митохондрий и модифицированная митохондриальная морфология — это именно те закономерности, которые мы могли бы предсказать, если бы уровни NO регулировали плотность митохондрий в тканях. На самом деле, NO может также играть роль в регуляции различий в размерах митохондрий у видов, различающихся по экспрессии белков, связывающих кислород. Мы обнаружили, что митохондрии у рыб без Mb/Hb значительно крупнее, чем у краснокровных рыб (O’Brien and Sidell, 2000). Более высокие уровни NO в тканях ледяной рыбы согласуются с результатами, свидетельствующими о том, что снижение продукции NO уменьшает размер митохондрий (Nisoli et al.
D.S., неопубликовано). Мы можем предсказать, что повышенные уровни NO приведут практически ко всем характерным признакам, которые мы описали для ледяных рыб. Повышенная плотность сосудов в ткани сетчатки и увеличенный диаметр просвета кровеносных сосудов в окислительных мышцах ледяных рыб согласуются с заметной активацией ангиогенных процессов, которую можно было бы ожидать в ответ на постоянно более высокие уровни NO.Точно так же повышенная плотность митохондрий и модифицированная митохондриальная морфология — это именно те закономерности, которые мы могли бы предсказать, если бы уровни NO регулировали плотность митохондрий в тканях. На самом деле, NO может также играть роль в регуляции различий в размерах митохондрий у видов, различающихся по экспрессии белков, связывающих кислород. Мы обнаружили, что митохондрии у рыб без Mb/Hb значительно крупнее, чем у краснокровных рыб (O’Brien and Sidell, 2000). Более высокие уровни NO в тканях ледяной рыбы согласуются с результатами, свидетельствующими о том, что снижение продукции NO уменьшает размер митохондрий (Nisoli et al. , 2004). Увеличение оксида азота также может быть причиной увеличения размера сердца ледяной рыбы. Мы обнаружили, что отношение массы сердца к массе тела нототениоидов коррелирует с экспрессией Mb и Hb, при этом значения у краснокровных видов являются наименьшими, у ледяных рыб, экспрессирующих Mb на промежуточном уровне, и у ледяных рыб, лишенных Mb, наибольших. Эти наблюдения согласуются с ролью NO в индуцировании сердечной гипертрофии у мышей без миоглобина.
, 2004). Увеличение оксида азота также может быть причиной увеличения размера сердца ледяной рыбы. Мы обнаружили, что отношение массы сердца к массе тела нототениоидов коррелирует с экспрессией Mb и Hb, при этом значения у краснокровных видов являются наименьшими, у ледяных рыб, экспрессирующих Mb на промежуточном уровне, и у ледяных рыб, лишенных Mb, наибольших. Эти наблюдения согласуются с ролью NO в индуцировании сердечной гипертрофии у мышей без миоглобина.
Любопытно, что повышенная концентрация NO может даже помочь прояснить неизвестное происхождение еще одной поразительной особенности мышц антарктических рыб.Размер мышечных волокон рыб обычно увеличивается по мере снижения температуры тела (Egginton and Johnston, 1984; Egginton and Sidell, 1989; Rodnick and Sidell, 1997; Johnston et al., 1998). Эта тенденция коррелирует с упомянутой ранее обратной зависимостью между гематокритом и температурой тела. Мышечные волокна антарктических рыб даже крупнее, чем волокна антарктических видов, а волокна антарктических ледяных рыб лежат на краю этого континуума, при этом площадь поперечного сечения окислительных мышечных волокон примерно в два раза больше, чем у краснокровных антарктических видов (O’ Брайен и др.,2003; Эггинтон и др., 2002). Во всех окислительных грудных мышцах антарктических видов отсутствуют Mb. Таким образом, более высокие уровни NO в результате потери Mb и Hb также могут влиять на поддержание необычно большого размера волокон в грудных мышцах ледяной рыбы.
Мышечные волокна антарктических рыб даже крупнее, чем волокна антарктических видов, а волокна антарктических ледяных рыб лежат на краю этого континуума, при этом площадь поперечного сечения окислительных мышечных волокон примерно в два раза больше, чем у краснокровных антарктических видов (O’ Брайен и др.,2003; Эггинтон и др., 2002). Во всех окислительных грудных мышцах антарктических видов отсутствуют Mb. Таким образом, более высокие уровни NO в результате потери Mb и Hb также могут влиять на поддержание необычно большого размера волокон в грудных мышцах ледяной рыбы.
Уникальная биология белокрылой ледяной рыбы была впервые обнаружена более 50 лет назад. Сегодня мы продолжаем много узнавать об основных биологических процессах, изучая этих необычных животных.Ледяные рыбы предоставили прекрасную возможность узнать больше о функциях белков, связывающих кислород, гемоглобина и миоглобина, а также об уникальных физиологических процессах, возникающих в отсутствие этих белков. Действительно, ледяные рыбы появились за несколько миллионов лет до появления хорошо изученных мышей без миоглобина.
Действительно, ледяные рыбы появились за несколько миллионов лет до появления хорошо изученных мышей без миоглобина.
Недавнее открытие Hb и Mb в качестве NO-оксигеназ побуждает нас вернуться к ледяным рыбам и исследовать их физиологию с новой точки зрения.Теперь у нас есть возможность задать вопрос: Какие потенциальные адаптации могут возникнуть в отсутствие активности NO-оксигеназы? Ответы захватывающие. Текущие исследования систем млекопитающих показывают, что почти все отличительные черты channichthyid могут быть результатом высокого уровня оксида азота, чего можно было бы ожидать при отсутствии Hb и Mb. Эти результаты в сочетании с методами молекулярной биологии помогут нам раскрыть генетические основы, которые привели к установлению многих отличительных черт ледяной рыбы, включая: высокую плотность сосудов и митохондрий, большой диаметр просвета капилляров и даже, возможно, увеличенные мышечные волокна. .
.
Новые белки глобина, цитоглобин и нейроглобин, недавно были идентифицированы у нескольких видов позвоночных (Pesce et al., 2002). Этот последний белок экспрессируется в тканях мозга и нейронов и участвует в борьбе с нитрозативным стрессом, вызванным высоким уровнем оксида азота (Herold et al., 2004). Интересно, что мы наблюдали отчетливый красноватый оттенок в ткани сетчатки C. aceratus , намекая на то, что это может быть гем-содержащий глобиновый белок, который экспрессируется у этого животного.Channichthyids, или “blodlaus fisk” (Ruud, 1954), несомненно, помогут нам узнать больше о функции этих белков в будущем и обеспечат нам по крайней мере еще 50 лет плодотворных исследований увлекательной физиологии этих животных.
|
Мы начали с этого копченого луфаря, намазанного на рогалик, а затем погрузились в копченую рыбу целиком.
|
Обзоры товаров / Основные закуски / Рыба, морепродукты и икраNantucket Wild Gourmet & SmokehouseLine-Caught, экологичные морепродукты
CAPSULE REPORT: В связи с большим спросом на морепродукты, чем может обеспечить океан, и влиянием некоторых методов коммерческого рыболовства на экосистемы, экологически чувствительные потребители ищут устойчивые варианты морепродуктов. Есть много копченого лосося, но Nantucket Wild Gourmet & Smokehouse занимается экологически чистыми морепродуктами. Вы можете чувствовать себя особенно хорошо, что рыбу ловят члены Ассоциации рыбаков-крючков, цель которой – устойчивость рыбы.Все морепродукты действительно дикие, а не выращенные, и их ловят рыбаки, у которых есть личные отношения с компанией. Что означает пойманная линия? Это как если бы вы были на рыбалке: рыба клюет, вы выматываете ее, достаете рукой и аккуратно опускаете. Это не массовая операция, когда ловят рыбу сетями, вытаскивают сотни бьющихся рыб и сбрасывают их в трюм. Пойманную на леску рыбу помещают в пену, чтобы она не задыхалась; их не бросают и не роняют, они не получают синяков. Холодное копчение и переработкаПродукты Nantucket Wild Gourmet & Smokehouse производятся методом холодного копчения. Горячее копчение или холодное копчение: в чем разница? Горячее копчение в основном готовит рыбу при более высокой температуре — текстура такая же, как если бы вы готовили ее дома. Холодное копчение – медленное копчение при низкой температуре; он оставляет полупрозрачность и больше влаги в мякоти. Каждая рыба обрабатывается индивидуально. У выращенной рыбы есть постоянство размеров и веса.Легко бросить 40 рыб в рассол и коптить их столько же времени. Размер и вес дикой рыбы существенно различаются; с каждой рыбой решать, сколько соли нужно, как долго ее коптить, — это искусство. Это мелкосерийная обработка — от шести до восьми рыб за раз. К счастью, у NWG&S есть современная коптильня, построенная два года назад, которая помогает им справиться с трудной задачей. Но в результате копчения рыбы, выловленной в дикой природе, рыбы по отдельности, каждая рыба будет иметь разный вкус. Разновидности копченой рыбы Настоящий буфет из копченой рыбы.Рыба имеет месячный срок хранения в холодильнике; их можно замораживать и размораживать в холодильнике или микроволновой печи.
†Название народа коренных американцев, населявших побережье Тихоокеанского Северо-Запада вдоль нижнего и среднего течения реки Колумбия, в современных Орегоне и Вашингтоне, где велся лов лосося. Компания также коптит тунца-альбакора, выловленного в водах Новой Англии. Сойти с ума: попробуйте дикую рыбу, пойманную на удочку. И отправьте немного своим кошерным друзьям на Рош ха-Шана.
Обратите внимание, что на момент написания этой статьи на сайте представлен только копченый лосось.Остальные товары Вы можете заказать по телефону: 1.508.945.2700. Цены и наличие уточняются при публикации, но могут быть изменены. Доставка дополнительно.
Lifestyle Direct, Inc. Все права защищены. Изображения являются собственностью их соответствующих владельцев. |
Некоторые пути энергетического обмена адаптированы к холоду у антарктических рыб
Изучены биохимические показатели метаболической холодовой адаптации в мышечных тканях экотипически сходных морских рыб Антарктики и умеренной зоны.Было проведено попарное сравнение медлительных донных обитателей (полярные: Notothenia gibberifrons; умеренных: Myoxocephalus octodecimspinosus ) и более активных пелагических (полярных: Trematomus newnesi; умеренных: Tautogaonitis ). в термальных местообитаниях, а не в истории жизни. Максимальная активность ферментов центральных путей аэробного энергетического обмена (цитратсинтаза, цитохромоксидаза) составила 1.В 5-5 раз выше в окислительных мышцах полярных видов, чем у собратьев из умеренной зоны, при анализе при 1 ° C. В аналогичных условиях ферментные маркеры окисления жирных кислот (карнитинпальмитоилтрансфераза, 3-гидроксиацил-КоА-дегидрогеназа) были 1,3-27-. раза выше в тканях полярных видов, в то время как аэробный (гексокиназа) и анаэробный (6-фосфофруктокиназа, пируваткиназа и лактатдегидрогеназа) метаболизм углеводов в целом ниже в тканях полярных рыб, чем рыб умеренной зоны.Эти данные предполагают значительную метаболическую холодовую адаптацию аэробного энергетического метаболизма, зависящего от жирных видов топлива у полярных видов, но отсутствие такой адаптации в путях углеводного метаболизма. У видов умеренной зоны острая термочувствительность между 1° и 10°C большинства катализаторов центральных путей аэробного энергетического метаболизма была ниже (Q 10 , как правило, < 2), чем у катализаторов путей анаэробного метаболизма (Q 10 вообще > 2).
в термальных местообитаниях, а не в истории жизни. Максимальная активность ферментов центральных путей аэробного энергетического обмена (цитратсинтаза, цитохромоксидаза) составила 1.В 5-5 раз выше в окислительных мышцах полярных видов, чем у собратьев из умеренной зоны, при анализе при 1 ° C. В аналогичных условиях ферментные маркеры окисления жирных кислот (карнитинпальмитоилтрансфераза, 3-гидроксиацил-КоА-дегидрогеназа) были 1,3-27-. раза выше в тканях полярных видов, в то время как аэробный (гексокиназа) и анаэробный (6-фосфофруктокиназа, пируваткиназа и лактатдегидрогеназа) метаболизм углеводов в целом ниже в тканях полярных рыб, чем рыб умеренной зоны.Эти данные предполагают значительную метаболическую холодовую адаптацию аэробного энергетического метаболизма, зависящего от жирных видов топлива у полярных видов, но отсутствие такой адаптации в путях углеводного метаболизма. У видов умеренной зоны острая термочувствительность между 1° и 10°C большинства катализаторов центральных путей аэробного энергетического метаболизма была ниже (Q 10 , как правило, < 2), чем у катализаторов путей анаэробного метаболизма (Q 10 вообще > 2). Если эти модели температурной чувствительности широко распространены, они могут помочь объяснить избирательное расширение аэробного метаболизма для поддержания активности при низких температурах тела.
Если эти модели температурной чувствительности широко распространены, они могут помочь объяснить избирательное расширение аэробного метаболизма для поддержания активности при низких температурах тела.
Codfish Fish Facts – AZ Animals
Этот пост может содержать партнерские ссылки на наших партнеров, таких как Chewy, Amazon и других. Покупка через них помогает нам продвигать миссию AZ Animals по просвещению о видах в мире. или род донных рыб Gadus.Наиболее распространенными видами являются атлантическая треска и тихоокеанская треска, которые тесно связаны между собой. Оба вида популярны как пища с несколько разными вкусовыми характеристиками, в то время как печень обоих видов используется для приготовления популярного домашнего средства из жира печени трески. Из-за высокого спроса атлантическая треска уязвима из-за высокого спроса.
5 Невероятных фактов о треске!
- Треска плотоядна и питается другой рыбой.
- Они медленно плавают.
- Они могут преодолевать до 200 миль, чтобы добраться до мест размножения во время брачного сезона.

- Самки могут откладывать до 5 миллионов икринок, большую часть из которых съедают другие рыбы и морские существа.
- Люди — единственные естественные враги или хищники трески.
Классификация трески и научное название
Слово «треска» относится к роду Gadus, но конкретно к представителям атлантической трески или семейства настоящих тресковых Gadidae, а также к трем родственным семействам отряда Gadiformes. Gadus включает в себя угря, камбалу, ската и минтая, а «треска» может означать атлантическую треску, тихоокеанскую треску или любой вид хека, минтая, пикши и налима.Однако некоторые виды, принадлежащие к роду Gadus, такие как минтай (Gadus chalcogrammus), не известны как треска.
Многие виды рыб из отряда окунеобразных также называют «треской», хотя они не являются настоящей треской. К ним относятся синяя треска ( Parapercis colias ), треска форель ( Maccullochella macquariensis ) и нототены (ледяная треска) семейства Nototheniidae, содержащие антарктическую треску ( Dissostichus mawsoni ), черную треску ( Notothenia microlepidothenia). и треска маори ( Paranotothenia magellanica ).
и треска маори ( Paranotothenia magellanica ).
Коралловая треска, рифовая треска и скальная треска также относятся к отряду окунеобразных. Многие виды относятся к груперам того же порядка, но относятся к семейству Serranidae и подсемейству Epinephelinae. Пикша ( Melanogrammus aeglefinus ) и мерланг ( Merlangius merlangus ) принадлежат к семейству Gadidae и иногда продаются как треска.
Виды трески
Существует три официальных вида трески: атлантическая треска (Gadus morhua), также называемая галантерейной треской, треской, треской, священной треской, рыночной или стейкерной; Тихоокеанская треска ( Gadus macrocephalus ), также называемая серой рыбой, серой треской, серым волком, аляскинской треской, настоящей треской или тарой; и гренландская треска ( Gadus ogac ), также называемая огаком, которая может не отличаться от тихоокеанской трески.Минтай с Аляски ( Gadus chalcogrammus ) обычно известен не под альтернативным названием снежная треска или большеглазая треска, а как минтай. Он тесно связан с атлантической треской.
Он тесно связан с атлантической треской.
Статьи с упоминанием трески
Смотрите все наши развлекательные и поучительные статьи о животных.
Внешний вид трески
Оба вида трески обычно имеют зелено-коричневый цвет, который может варьироваться от серо-зеленого до красно-коричневого, с более светлой нижней стороной и белым низом живота.Оба имеют три спинных плавника, два анальных плавника и пару грудных плавников. У них также есть бородоподобный усик на подбородке, который служит органом чувств для поиска пищи. У них также есть темные крапинки на боках и белая боковая линия, которая проходит от жаберной щели до основания хвоста и служит для обнаружения движения, вибрации и давления в окружающей воде. Наконец, структура черепа, называемая отолитом, имеет видимые кольца, количество которых определяет возраст трески.
Тихоокеанская треска меньше и темнее атлантической трески, ее вес достигает 50 фунтов (22,5 кг).7 кг) со средним весом 33 фунта (15 кг). Верный своему прозвищу серая треска, он коричневато-серого цвета. Атлантическая треска может достигать 220 фунтов (100 кг) при среднем весе 212 фунтов (96 кг) и имеет серебристый подкожный слой с телом желто-зеленого или красно-оливкового цвета. В длину они могут быть от 77 до 200 см (30-79 дюймов), в среднем 51 дюйм или более метра.
Верный своему прозвищу серая треска, он коричневато-серого цвета. Атлантическая треска может достигать 220 фунтов (100 кг) при среднем весе 212 фунтов (96 кг) и имеет серебристый подкожный слой с телом желто-зеленого или красно-оливкового цвета. В длину они могут быть от 77 до 200 см (30-79 дюймов), в среднем 51 дюйм или более метра.
Владимир Врангель/Shutterstock.com
Распространение, популяция и среда обитания трески
Атлантическая треска обитает в глубоких и холодных водах Северной Атлантики.Тихоокеанская треска обитает как в восточных, так и в западных районах северной части Тихого океана, включая воды Аляски и России. Оба вида можно найти на глубине от 20 до 200 футов, а тихоокеанскую треску можно найти на глубине 900 м (3000 футов). Как донные рыбы, они живут и питаются на морском дне. Хотя спрос на оба вида высок, атлантическая треска занесена в список МСОП как уязвимый вид.
Треска Хищники и добыча
Треска — главный хищник с плотоядной и даже каннибалистической диетой. Они потребляют множество существ, включая другую, более мелкую рыбу (рыбу-жертву или наживку), ракообразных и беспозвоночных.
Они потребляют множество существ, включая другую, более мелкую рыбу (рыбу-жертву или наживку), ракообразных и беспозвоночных.
Чем питается треска?
Мелкая рыба, включая пикшу, скумбрию, путассу, червей, мидий, моллюсков, омаров, крабов, кальмаров и песчаных угрей.
Чем питается треска?
Люди являются единственным естественным хищником или врагом трески, которая является высшим хищником. Молодь трески также может стать добычей взрослой трески.
Размножение и продолжительность жизни трески
Жизненный цикл трески начинается с нереста. Треска медленно плавает, но во время брачного сезона может преодолевать до 200 миль к местам размножения.Они могут размножаться круглый год, но весной и зимой мигрируют в более теплые воды. Нерест происходит с января по апрель, пик сезона приходится на март и апрель. Диапазон их глубин в это время составляет 660 футов. Во время ухаживания самцы трески демонстрируют свои плавники и хрюкают.
Самки могут откладывать до 500 миллионов яиц. После того, как они откладывают яйца партиями, самцы соревнуются за их оплодотворение. Яйца уязвимы для элементов, и большинство из них поедается другими рыбами и морскими существами. Остальные вылупляются через 8-23 дня, при этом личинки на вид прозрачные и только 0.16 дюймов в длину. Их размер увеличивается в 40 раз через 10 недель, поскольку они питаются фитопланктоном и зоопланктоном, а затем поедают мелких ракообразных. В 6 месяцев они достигают 3,1 дюйма (8 см) в длину. Они становятся половозрелыми в возрасте от 2 до 4 лет, когда достигают длины 20 дюймов (50 см).
После того, как они откладывают яйца партиями, самцы соревнуются за их оплодотворение. Яйца уязвимы для элементов, и большинство из них поедается другими рыбами и морскими существами. Остальные вылупляются через 8-23 дня, при этом личинки на вид прозрачные и только 0.16 дюймов в длину. Их размер увеличивается в 40 раз через 10 недель, поскольку они питаются фитопланктоном и зоопланктоном, а затем поедают мелких ракообразных. В 6 месяцев они достигают 3,1 дюйма (8 см) в длину. Они становятся половозрелыми в возрасте от 2 до 4 лет, когда достигают длины 20 дюймов (50 см).
Жизненный цикл трески протекает от икры к личинке, от ювенильной до взрослой стадии. Личинки называются мальками, а молодь трески – мальками. Взрослая треска может жить в дикой природе 13 и более лет в зависимости от вида.Атлантическая треска, например, живет в дикой природе 25 лет, а тихоокеанская треска обычно живет 20 лет. Различия во времени, которое требуется молодым особям для достижения половой зрелости, не меняют основной жизненный цикл. Например, треске в северо-восточной Арктике может потребоваться до 8 лет, чтобы полностью созреть.
Например, треске в северо-восточной Арктике может потребоваться до 8 лет, чтобы полностью созреть.
Треска в кулинарии и рыболовстве
Треска, высушенная без соли, называется вяленой. Более популярный метод консервирования сушеной и соленой трески известен как соленая треска, соленая рыба, вяленая соленая треска или клипфиш.Он производится путем сушки после засолки, также известной как соление, что делает его пригодным для длительного хранения, круглогодичного экспорта и добавления в различные блюда. Создание соленой рыбы сделало треску одной из самых многочисленных, прибыльных и важных рыб в европейском рыболовстве.
Соленая рыба – фирменное блюдо и уникальная основа для многих рецептов из трески по всему миру. Являясь основным экспортным продуктом Североатлантического региона, он является ингредиентом многих атлантических и средиземноморских кухонь, таких как испанская, португальская и итальянская.Например, есть несколько вариантов рагу из трески и жареных оладий из трески (также называемых оладьями из соленой рыбы или пирожками из соленой трески), которые требуют специально соленой трески.
Также во многих блюдах используется обычная треска. Рыба с жареным картофелем — популярный пример, зародившийся в Англии. Хотя треска по-прежнему является лучшим выбором, многие продавцы заменяют ее каменным лососем или белой рыбой, такой как палтус, пикша или камбала. Запеченная треска, обжаренная на сковороде треска, рыбные тако, рыбные палочки, рыбная похлебка, тушеная треска и суп из трески — другие примеры блюд, в которых используется обычная треска.Плотное, белое, слоеное и мягкое на вкус мясо трески чрезвычайно универсально и вполне взаимозаменяемо с другими видами сига.
С точки зрения питания, треска – это рыба с самым высоким содержанием белка на калорию, будь то атлантическая или тихоокеанская треска. Оба также обеспечивают значительное количество витаминов группы В, фосфора и селена. Треска настолько хорошо известна своими питательными свойствами, что популярным старым семейным средством является использование жира печени трески для лечения ран, артрита, депрессии и рахита.%201f.jpg) Масло производится из печени трески обоих видов и содержит высококонцентрированные количества омега-3 жирных кислот (EPA и DHA) и витаминов A, D и E.
Масло производится из печени трески обоих видов и содержит высококонцентрированные количества омега-3 жирных кислот (EPA и DHA) и витаминов A, D и E.
Во вкусе между двумя видами существуют небольшие различия. У тихоокеанской трески твердые, крупные хлопья с более мягким и пикантным вкусом. Атлантическая треска имеет более крупные, сладкие, твердые и «слоистые» хлопья, меньшее содержание влаги и больший размер рынка. В то время как люди в Соединенных Штатах привыкли к тихоокеанской треске и минтаю, люди в Великобритании наслаждаются атлантической треской, которую они называют «скрод» в возрасте до 2 лет.5 фунтов
Популяция трески
Существует несколько различных запасов каждого вида, которые исследуются на биомассу или количество воспроизводящихся самок. Тихоокеанская треска не подвергается перелову. Однако из-за перелова в конце 20 века атлантическая треска является уязвимым видом, популяция которого значительно сократилась. План восстановления для достижения целевого уровня популяции включает в себя правила и ограниченный статус рыболовства. Промысел тихоокеанской трески также регулируется квотами на рыболовные ловушки.
Промысел тихоокеанской трески также регулируется квотами на рыболовные ловушки.
Просмотреть все 115 животных, названия которых начинаются с буквы C
Черви, мелкие рыбы, ракообразные и беспозвоночные.
Атлантический и Тихий океаны.
Вид хищных морских рыб рода Gadus.
Да, треска и треска взаимозаменяемы. Тем не менее, «треска» относится к настоящей треске, в то время как «треска» может быть общим названием как для настоящей трески, так и для тресковой рыбы.
Чем атлантическая треска отличается от тихоокеанской трески?
Это два близкородственных вида трески, отличающихся внешним видом, питанием и районами обитания.
В чем разница между пикшей и треской?
Треска принадлежит к тому же семейству, что и пикша, семейство Gadidae, атлантическая треска или семейство настоящих тресковых. Пикшу иногда продают как треску. Оба являются холодными морскими рыбами, но отличаются размером и формой тела, цветом тела, передним спинным плавником и боковой линией. У них также разный вкус: треска имеет мягкий, чистый вкус и более толстое и твердое филе, которое отлично подходит для жарки и обжаривания, а пикша имеет рыбный вкус с более тонким и хрупким филе, которое лучше всего подходит для жарки.
У них также разный вкус: треска имеет мягкий, чистый вкус и более толстое и твердое филе, которое отлично подходит для жарки и обжаривания, а пикша имеет рыбный вкус с более тонким и хрупким филе, которое лучше всего подходит для жарки.
Треска живет 15-25 лет.
Существует 3 вида трески.
Треска — любимая еда во всем мире.
Треску также называют треской или треской.
Численность популяции трески неизвестна.
Треска поедает другую рыбу.
Треска откладывает икру.
Рыбное дерево жизни
PHLAWD использует подход с наживкой, при котором последовательности интересующей клады сравниваются с последовательностями NCBI GenBank и используются для загрузки гомологичных областей генов.Мы получили последовательности-приманки для 24 генов из нескольких источников: набор «ETOL», из проекта Euteleost Tree of Life, набор «Rabosky» и набор «Near».
Во всех анализах PHLAWD использовалась модифицированная версия оригинального программного обеспечения. Первоначальная версия PHLAWD перешла в режим обслуживания в сентябре 2012 года и впоследствии была изменена Коди Хинчлиффом для исправления ряда ошибок и ускорения анализа. Наша модифицированная версия исправляет другие ошибки и поддерживает ежедневные обновления в дополнение к выпуску GenBank раз в два месяца.
Первоначальная версия PHLAWD перешла в режим обслуживания в сентябре 2012 года и впоследствии была изменена Коди Хинчлиффом для исправления ряда ошибок и ускорения анализа. Наша модифицированная версия исправляет другие ошибки и поддерживает ежедневные обновления в дополнение к выпуску GenBank раз в два месяца.
Наша модифицированная версия PHLAWD затем оценивает эти гомологичные последовательности на насыщенность и, если они насыщены, разбивается на подматрицы, выровненные с помощью MAFFT, соответствующей пользовательской таксономии или справочному дереву. Мы провели опосредованный PHLAWD поиск в GenBank для каждого гена с параметрами MAD (медианное среднее отклонение) = 0,01, охват = 0,2 и идентичность = 0,2 для таксона NCBI Actinopterygii. Используя таксономию NCBI, эти субматрицы затем были выровнены вместе, используя выравнивание профиля, как предусмотрено в MUSCLE.Мы использовали GNU Parallel для распараллеливания этого поиска, поскольку встроенное в PHLAWD распараллеливание иногда может останавливаться при использовании большого количества потоков.
Чтобы еще больше увеличить генетический охват нашего набора данных, мы загрузили полные последовательности базы данных Barcode of Life (BOLD) и извлекли самый длинный ген субъединицы 1 цитохромоксидазы ( coi ) для каждого вида Actinopterygii. Мы также загрузили полные митохондриальные хромосомы для каждого вида актиноптеригов и извлекли гены nd2 и nd4 .Это предварительное сопоставление включало 15 606 видов.
Таблица: Источники генов для анализа PHLAWD. Источники, отмеченные (*), не использовались для поисковых запросов PHLAWD, а вместо этого включались непосредственно в матрицу символов.
| Имя гена | ЭТОЛ | Рабочий | Рядом с | ЖИРНЫЙ* | мт-геном* |
|---|---|---|---|---|---|
| 12 с | ✔ | ||||
| 16 с | ✔ | ✔ | |||
| 4c4 | ✔ | ||||
| кои | ✔ | ||||
| цитб | ✔ | ||||
| enc1 | ✔ | ✔ | ✔ | ||
| фикд | |||||
| глит | ✔ | ✔ | ✔ | ||
| hoxc6a | ✔ | ||||
| киаа1239 | ✔ | ||||
| мойх6 | ✔ | ✔ | ✔ | ||
| нд2 | ✔ | ||||
| нд4 | ✔ | ||||
| панкс2 | ✔ | ||||
| Плагл2 | ✔ | ✔ | ✔ | ||
| номер | ✔ | ✔ | |||
| тряпка1 | ✔ | ✔ | ✔ | ||
| тряпка2 | ✔ | ||||
| родопсин | ✔ | ✔ | |||
| рипк4 | ✔ | ||||
| ш4пкс3 | ✔ | ✔ | |||
| боковой ключ | ✔ | ||||
| среб2 | ✔ | ✔ | ✔ | ||
| свип1 | ✔ | ||||
| тбр1 | ✔ | ✔ | ✔ | ||
| vcpip | ✔ | ||||
| zic1 | ✔ | ✔ | ✔ |
Чтобы отфильтровать ошибочно идентифицированные последовательности, мы провели локальный поиск нуклеотидов BLAST в наших комбинированных PHLAWD и митохондриальных последовательностях. Используя самое близкое несамосоответствие BLAST, мы гарантировали, что ни одна последовательность PHLAWD не соответствует высокой идентичности видам за пределами исходного семейства видов, и проверили наличие контаминации, исключив последовательности, которые соответствуют высокой идентичности неактиноптеригиям, таким как . Хомо .
Используя самое близкое несамосоответствие BLAST, мы гарантировали, что ни одна последовательность PHLAWD не соответствует высокой идентичности видам за пределами исходного семейства видов, и проверили наличие контаминации, исключив последовательности, которые соответствуют высокой идентичности неактиноптеригиям, таким как . Хомо .
Например, последовательность enc1 для Amia calva (инвентарный номер EF032974.1) в семействе Amiidae на 99,87% совпадает с Lepomis cyanellus (инвентарный номер KF139483.1), в семействе Centrarchidae, несмотря на то, что для этого вида есть другие enc1 , более близкие. Поэтому эта конкретная последовательность была исключена из окончательного анализа.
Мы использовали ранее описанные протоколы секвенирования для получения новых мультилокусных данных для 442 видов. Они были напрямую добавлены и выровнены с матрицей символов. Затем выравнивание проверяли на качество, чтобы убедиться, что кодирующие гены находятся в кадре. Затем эти выравнивания были объединены для последующего анализа.
Затем эти выравнивания были объединены для последующего анализа.
Таблица: Новые последовательности по генам.
| Виды | enc1 | глит | мойх6 | плагл2 | птр | тряпка1 | ш4пкс3 | среб2 | тбр1 | зик1 |
|---|---|---|---|---|---|---|---|---|---|---|
| Акантистий цинктус | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Acanthostracion quadricornis | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Ахиропетта трихолепис | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Акропома японская | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Этотаксис митоптерикс митоптерикс | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Акаротаксис нудицепс | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Allotoca catarinae | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Altolamprologus calvus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Алутерус скриптус | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Амансес Скопас | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Золотистый амблиглифидодон | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Амблиопсис розовый | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Amblyopsis spelaea | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Аммокрипта beanii | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Аммокрипта бифасция | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Аммокрипта клара | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Амфиприон хризоптерус | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Анаблепс | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Anablepsoides hartii | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Andinoacara rivulatus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Гиб афредодерус | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Apistus carinatus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Аплодактиль арктиденс | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Апогон бинотатус | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Апогон пятнистый | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Апогон планифронс | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Ариомма Бонди | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Ариомма индикум | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Ариомма меланум | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Аротрон звездчатый | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Arripis Trutta | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Артедидрако мирус | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Artedidraco orianae | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Артедидрако Шаклетони | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Артедидрако Скоттсберги | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Астатотилапия блойети | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Астатотилапия буртони | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Астрапогон точечный | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Астронотус вид | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Atypichthys latus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Aulonocranus dewindti | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Austrofundulus leohoignei | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Austrolebias nigripinnis | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Азурина Хирундо | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Bathybates fasciatus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Батиклюпея серебристая | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Батиклюпея тонкая | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Батидрако антарктический | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Bathydraco macrolepis | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Батидрако Марри | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Батидрако шотландский | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Батистет культурный | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Benitochromis batesii | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Benthochromis tricoti | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Biotoecus opercularis | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Boulengerochromis microlepis | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Бовичтус пестрый | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Cantherhines pardalis | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Canthigaster coronata | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Canthigaster rostrata | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Какетая Крауссии | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Cardiopharynx schoutedeni | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Centropomus ensiferus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Chaenocephalus aceratus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Ченодрако Вильсони | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Champsocephalus esox | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Champsocephalus gunnari | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Channichthys rhinoceratus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Чаудхурия хвостатая | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Cheilodipterus artus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Chelonodon patoca | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Четиа мола | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Chilomycterus reticulatus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Chilotilapia rhoadesii | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Хионодрако хаматус | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Хионодрако майерси | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Хионодрако растроспинозус | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Хиронем двурогий | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Пятнистый хиронемус | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Хонерхинос наритус | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Хрионема фурунои | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Chrysiptera brownriggii | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Цихлазома боливийская | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Клейтракара марони | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Congiopodus leucopaecilus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Гобио Cottoperca | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Crapatalus munroi | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Креничихла свени | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Криодрако антарктический | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Криодрако Аткинсони | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Cryptoheros sajica | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Crystallaria asprella | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Cygnodraco mawsoni | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Цифотилапия лобная | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Циприхромис лептосома | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Cyrtocara moorii | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Дакодрако хантери | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Dascyllus aruanus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Дихистиус капский | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Дихистий многофасциальный | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Дикросс нитевидный | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Динолестес левини | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Диноперка петерси | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Диодон гистрикс | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Дисхистодус меланотус | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Dissostichus mawsoni | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Doederleinia berycoides | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Dolloidraco longedorsalis | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Эхиихтис гадюка | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Enigmapercis sp | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Эпигон телескопический | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Эретмодус синюшный | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Erilepis zonifer | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Этеостома акатуло | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Этеостома артезия | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Etheostoma asprigene | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Этеостома южная | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Этеостома бейли | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Этеостома бородка | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Бесплодная этеостома | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Этеостома беллатор | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Etheostoma binotatum | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Etheostoma blennioides | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Этеостома морская | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Этеостома голубая | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Этеостома шейки матки | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Этеостома cf | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Этеостома китайская | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Etheostoma chlorosomum | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Etheostoma cinereum | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Коза этеостомы | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Этеостома дитрема | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Этеостома дури | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Этеостома эузонум | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Etheostoma flabellare | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Этеостома форбези | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Веретенообразная этеостома | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Этеостома изящная | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Etheostoma histrio | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Этеостома хопкинси | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Etheostoma jessiae | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Этеостома Канава | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Этеостома узел | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Этеостома чешуйчатая | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Длинная этеостома | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Этеостома лютеовинктум | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Etheostoma Lynceum | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Морская этеостома | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Средняя этеостома | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Этеостома микроперка | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Черная этеостома | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Etheostoma okaloosae | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Этеостома оливковая | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Этеостома олмстеди | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Этеостома бледная | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Etheostoma parvipinne | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Etheostoma phytophilum | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Этеостома выступающая | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Etheostoma pseudovulatum | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Этеостома пиррогастра | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Etheostoma rafinesquei | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Etheostoma rupestre | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Стрельчатая этеостома | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Зажим для этеостомы | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Этеостома Смити | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Этеостома рыльце | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Etheostoma thalassinum | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Этеостома тройчатая | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Этеостома тускумбия | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Этеостома витреум | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Зональная этеостома | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Эвиота абакс | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Forbesichthys agassizii | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Forbesichthys papilliferus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Гамбузия голбруки | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Геофаг ипорангенсис | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Герлахея австралийская | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Черная гирелла | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Glossogobius olivaceus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Glyptauchen panduratus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Gnathochromis pfefferi | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Gobiocichla ethelwynnae | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Гобионототен острый | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Гобионототен гибберифронс | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Gobionotothen marionensis | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Goodea atripinnis | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Grahamichthys radiata | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Graus nigra | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Мраморные гимнастики | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Gymnocephalus cernua | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Гимнодрако остроконечный | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Гимногобиус бреунигии | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Hapalogenys Dampieriensis | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Haplochromis latifasciatus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Гаплохромис желтый | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Haplotaxodon microlepis | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Harpagifer antarcticus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Hemichromis elongatus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Hemichromis letourneuxi | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Hemichromis sp | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Гемиглифидодон плагиометопон | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Эрмосилья лазурная | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Гистиодрако велифер | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Гипселекара височная | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Hypsypops rubicundus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Inimicus didactylus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Конья Айзентраути | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Крамерия Брайани | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Кифоз сектатрикс | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Lactarius lactarius | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Лактория роговая | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Лаэтакара курвицепс | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Lagocephalus laevigatus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Lateolabrax latus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Поздний микролепис | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Латридопсис форстери | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Latris lineata | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Lepadichthys lineatus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Лепидонототен ларсени | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Lepidonotothen nudifrons | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Чешуекрылые чешуекрылые | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Lepidozygus Tapinosoma | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Лептобрама мюллери | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Lesueurina platycephala | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Limnichthys fasciatus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Limnotilapia dardennii | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Liopropoma mowbrayi | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Liopropoma susumi | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Липограмма трехлинейная | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Lophotus capellei | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Мэрилина Дарвини | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Мацубарея веретенообразная | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Меценихтис иммакулатус | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Медиалуна калифорнийская | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Мезонавта эгрегиус | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Мезонавта праздничная | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Mesonauta insignis | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Мезонавта мирификус | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Метавелифер многолучевой | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Микрогеофагус рамирези | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Веритас Мильеринга | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Minous trachycephalus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Монакант китайский | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Лейрус монотрете | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Мяка Мяка | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Нандопсис сальвини | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Нандопсис тетракантус | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Нанохромис парилус | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Неоглифидодон мелас | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Неолампролог короткий | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Neolamprologus toae | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Неопагетопсис ионах | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Неопомацентрус немурус | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Неосебастес тетидис | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Normanichthys crockeri | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Nothobranchius furzeri | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Nothonotus acuticeps | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Nothonotus camurus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Нотонотус чаквахатте | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Nothonotus jordani | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Nothonotus juliae | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Нотонотус пятнистый | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Nothonotus rufilineatus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Nothonotus tippecanoe | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Notothenia angustata | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Notothenia coriiceps | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Нототения россии | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Окосия заспилота | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Ophiocara porocephala | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Офиодон удлиненный | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Офтальмотиляпия брюшная | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Oreochromis tanganicae | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Orthochromis luongoensis | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Озопсарон формосенсис | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Oxymonacanthus longirostris | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Pagetopsis macropterus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Пажетопсис пятнистый | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Pagothenia borchgrevinki | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Пагрус Пагрус | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Paracentrogon rubripinnis | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Parachaenichthys charcoti | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Parachaenichthys georgianus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Parachromis managuensis | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Paracyprichromis brieni | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Parahollardia lineata | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Паретроплюс дамбабе | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Парма микролепис | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Патагонототен Рог | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Патагонототен Элеганс | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Патагонототен Гунтери | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Длинноногие патагонототенские | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Патагонототен Рамсайи | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Патагонототен Сима | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Патагонототен сквамицепс | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Патагонототен мозаичный | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Патагонототен Уилтони | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Перка шренки | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Percina aurantiaca | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Percina aurolineata | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Percina bimaculata | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Percina carbonaria | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Перчина cf | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Перчина копеланди | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Percina crassa | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Перчина Эвидс | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Перчина куша | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Percina macrocephala | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Percina maculata | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Percina nevisense | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Percina oxyrhynchus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Ладонная окунь | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Percina peltata | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Перчина роанока | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Percina sciera | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Перчина шумарди | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Percina stictogaster | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Персина бдение | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Percophis brasiliensis | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Percopsis transmontana | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Петрохромис полиодон | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Phaeoptyx conklini | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Plecodus straeleni | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Plectroglyphidodon dickii | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Pleuragramma antarctica | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Pogonophryne barsukovi | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Pogonophryne cerebropogon | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Pogonophryne eakini | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Pogonophryne immaculata | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Pogonophryne macropogon | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Погонофрин мраморный | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Погонофрин Скотти | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Полиприон американский | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Помацентрус нигроманус | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Помахромис ричардсони | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Premnas biaculeatus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Прионодрако эвансии | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Пристиапогон каллоптерус | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Глубокие губы | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Psammoperca waigiensis | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Psedocrenilabrus sp | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Псевдофрит урвиллий | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Pseudochaenichthys georgianus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Pseudosimochromis curvifrons | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Псевдотриакант стригилифер | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Псилодрако короткий | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Птерофиллум леопольди | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Птеропсарон спрингери | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Птилихтис гудэй | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Ptychochromis oligacanthus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Пунгу макларени | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Раковиция ледяная | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Реганохромис каллиурус | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Ретрокулюс сингуенсис | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Рейнкантус колючий | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Риацихтис аспро | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Росио осьмифасциата | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Романихтис валсаникола | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Розенблатия робуста | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Стекловидный шлифовальный станок | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Саротеродон галилеус | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Satanoperca jurupari | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Скомбролабракс гетеролепис | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Бупсы Скомбропса | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Скомбропс Жильберти | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Скорпион фиолетовый | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Серранохромис узколистный | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Sicyopterus japonicus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Спатодус марльери | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Speoplatyrhinus poulsoni | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Sphaeramia nematoptera | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Sphoeroides pachygaster | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Спикара южная | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Спикара смарис | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Steatocranus tinanti | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Steatocranus ubanguiensis | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Stephanolepis cirrhifer | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Стоматепия пинду | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Симфизанодон ягодный | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Symphysanodon octoactinus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Synagrops philippinensis | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Такифугу глазчатая | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Tetragonurus cuvieri | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Тетраодон мбу | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Тевара кранвелла | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Таласселеотрис йота | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Торакохромис Брауски | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Торихтис мики | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Морская тилапия | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Тилапия рувети | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Тилапия спарманийская | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Тилодон сексфасциатус | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Tomocichla sieboldii | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Торкигенера плеврограмма | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Драко Трахин | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Trematomus bernacchii | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Trematomus eulepidotus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Trematomus hansoni | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Trematomus lepidorhinus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Trematomus loennbergii | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Trematomus newnesi | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Trematomus nicolai | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Trematomus pennellii | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Trematomus scotti | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Trematomus tokarevi | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Trematomus vicarius | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Triacanthodes ethiops | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Triacanthus nieuhofii | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Trichonotus elegans | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Трихонотус нитевидный | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | |
| Trichonotus setiger | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Триксифихтис вебери | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Tropheus duboisi | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Тидемания навигаторис | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Tylochromis lateralis | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Тилохромис милодон | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Typhlichthys subterraneus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Тираннохромис нигривентер | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Уару амфиакантоидный | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Vomeridens infuscipinnis | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Йонгейхтис кринигер | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Zalembius rosaceus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Zanclorhynchus spinifer | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Zaprora silenus | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Зингель Аспер | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Зингель Зингель | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
| Зу удлиненный | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ | ✔ |
Мы написали специальный веб-скребок на Python для загрузки всех принятых научных названий, синонимов и таксономии для рыб Actinopterygii из FishBase. Затем мы загрузили все выровненные последовательности PHLAWD в базу данных SQLite, чтобы записать все таксономические изменения в согласованном формате.
Затем мы загрузили все выровненные последовательности PHLAWD в базу данных SQLite, чтобы записать все таксономические изменения в согласованном формате.
Затем мы использовали специальный скрипт Python, чтобы попытаться согласовать названия видов GenBank с нашей известной таксономией FishBase. Названия видов были сопоставлены с использованием следующих алгоритмов в порядке:
.
- Точное научное название
- Точный допустимый синоним
- Точное общее название
- Точное научное название без подвидового эпитета
- Точный действительный синоним, без эпитета подвида
- Применение ручных таксономических поправок
- Нечеткое сопоставление с научными названиями на основе алгоритма сопоставления гештальт-образцов
- Нечеткое сопоставление с действительными синонимами на основе алгоритма сопоставления гештальт-образца
- Добавление однозначных, но не совпадающих видов с более чем 2 генами, так как это, вероятно, новые виды, которые еще не были включены в FishBase
После этих автоматических механизмов мы проверили совпадения вручную и вручную исправили любые неправильные назначения, а затем проверили последовательности, которые были идентичными, но были сопоставлены с разными видами. Наш процесс таксономического согласования соответствовал 46/46 отрядам рыб (100%), 454/480 семействам (94,6%) и 3368/4853 родам (69,4%) по данным FishBase.
Наш процесс таксономического согласования соответствовал 46/46 отрядам рыб (100%), 454/480 семействам (94,6%) и 3368/4853 родам (69,4%) по данным FishBase.
| Метод сопоставления | Граф |
|---|---|
| Точное научное название | 11 368 |
| Точный синоним | 623 |
| Ручная таксономическая коррекция | 131 |
| Непревзойденный, но однозначный | 84 |
| Точное научное название, без подвида | 69 |
| Нечеткое научное название | 61 |
| Нечеткий синоним | 12 |
| Точный синоним, без подвида | 9 |
Таблица: Таксономическая сверка по типу соответствия.
Чтобы исключить таксоны-изгои, которые снижают бутстреп-поддержку филогений из-за их нестабильного положения, мы провели анализ RogueNaRok и искали наборы до 3 видов, которые можно было бы исключить, чтобы улучшить бутстреп-поддержку при неограниченном филогенетическом анализе. RogueNaRok итеративно удаляет таксоны и оценивает их влияние на поддержку начальной загрузки; это влияние зависит от идентичности всех других таксонов, удаленных до него. Поэтому мы исключили все таксоны или наборы таксонов до такой степени, что удаление любых последующих таксонов не улучшило бы поддержку начальной загрузки более чем на 1.Всего таким образом было удалено 645 видов, при этом 152 и 102 вида были удалены как часть набора из 2 и 3 видов соответственно.
RogueNaRok итеративно удаляет таксоны и оценивает их влияние на поддержку начальной загрузки; это влияние зависит от идентичности всех других таксонов, удаленных до него. Поэтому мы исключили все таксоны или наборы таксонов до такой степени, что удаление любых последующих таксонов не улучшило бы поддержку начальной загрузки более чем на 1.Всего таким образом было удалено 645 видов, при этом 152 и 102 вида были удалены как часть набора из 2 и 3 видов соответственно.
Мы провели первоначальный поиск по дереву с использованием RAxML v8.1.17 с использованием критерия сходимости быстрого поиска ML для больших деревьев (опция -D ) и реализации на основе SEV для столбцов пробелов (опция -U ) . Анализ занял около 4 дней работы на 24-ядерном вычислительном компьютере Intel Xeon E5-2690v3 x2.
| ген | п | ген | п |
|---|---|---|---|
| 12 с | 27 | птр | 13 |
| 16 с | 84 | тряпка1 | 27 |
| 4c4 | 17 | тряпка2 | 6 |
| кои | 175 | родопсин | 20 |
| цитб | 70 | рипк4 | 8 |
| enc1 | 9 | ш4пкс3 | 8 |
| фикд | 14 | боковой ключ | 8 |
| глит | 1 | среб2 | 4 |
| hoxc6a | 7 | свип1 | 6 |
| киаа1239 | 5 | тбр1 | 11 |
| мойх6 | 15 | vcpip | 8 |
| панкс2 | 11 | zic1 | 14 |
| Плагл2 | 9 | Всего последовательностей | 577 |
Таблица: Последовательности генов, исключенные из-за мошеннического поведения или соответствия BLAST высокой идентичности за пределами назначенного семейства их видов.
Затем мы создали отдельные филогении на уровне семейства, извлекая поддерево, происходящее от самого последнего общего предка всех видов в каждом семействе, и автоматически помечая таксоны-потомки, которые были вне основного семейства. Затем мы оценили качество филогении для каждой семьи и отметили все таксоны, которые демонстрировали мошенническое поведение.
Затем мы удалили наконечники с очень длинными ветвями, поскольку они потенциально указывали на области низкого качества или выравнивания последовательности.Используя окончательный отфильтрованный набор данных, который содержал 11 644 подсказки, мы повторно провели анализ максимального правдоподобия в RAxML и вычислили значения поддержки узлов, используя SH-подобную статистику , поскольку она консервативна при оценке значений поддержки, такой как стандартная загрузка, но работает намного быстрее. Топологию, оптимизированную для NNI, со значениями поддержки, подобными SH, можно скачать здесь.
Мы разработали обширный список основанных на окаменелостях минимумов расхождений в филогении актиноптеригий. Многие из них получены из прошлых анализов молекулярных часов, но другие являются новыми для этого исследования.Вымершие таксоны вместе с соответствующими филогенетическими и возрастными обоснованиями представлены в дополнительных данных: отчет о калибровке. Мы применили эти окаменелости в качестве калибровки на основе узлов с верхней границей возраста, заданной модифицированной реализацией расширения всего дерева алгоритма Хедмана (WHETA ). Этот подход дает вероятностные ограничения максимального возраста для заданных узлов на основе: минимального возраста, определяемого самой старой окаменелостью, произошедшей от этого узла; стратиграфически непротиворечивая последовательность более старых внешних групп ископаемых к этому узлу; и жесткий максимальный возраст, установленный следователем.Мы приняли комплексный подход к определению этих последовательностей внешних групп (ср. ), применяя как стратиграфически согласованные калибровки, включенные в наш собственный набор основанных на ископаемых минимумах, так и последовательности ископаемых, чье филогенетическое положение было хорошо известно, но которые не использовались в качестве сами калибровочные минимумы. Последовательности, основанные на первом, автоматически сопоставлялись с помощью пользовательского алгоритма. Там, где это уместно, к этому набору внешних групп добавлялись дополнительные возрасты ископаемых внешних групп.
), применяя как стратиграфически согласованные калибровки, включенные в наш собственный набор основанных на ископаемых минимумах, так и последовательности ископаемых, чье филогенетическое положение было хорошо известно, но которые не использовались в качестве сами калибровочные минимумы. Последовательности, основанные на первом, автоматически сопоставлялись с помощью пользовательского алгоритма. Там, где это уместно, к этому набору внешних групп добавлялись дополнительные возрасты ископаемых внешних групп.
Мы применили две такие последовательности: стволовые линии костистых костей, последовательно более удаленные от короны костистых костей, указанные и обновленные , и набор ископаемых внешних групп к существующим хондростам. Последнее является новым для данного исследования и основано на кладистических гипотезах хрящевых взаимосвязей, данных в . По мере приближения к хрящевой кроне, с возрастом, указанным в скобках, эта последовательность выглядит так: Birgeria groenlandia (250.1 млн лет назад), Chondrosteus acipenseroides (193.81) и Peipiaosteus pani (129.3). Возрастные обоснования аналогичны тем, которые даны для других таксонов из тех же геологических единиц (например, Chondrosteus acipenseroides встречается совместно с Dorsetichthys bechei , который включен в серию стволовых костистых рыб, указанную под номером ). затем подвергли алгоритму Хедмана с жестким верхним возрастным ограничением 430 млн лет. Этот выбор максимального возраста вряд ли существенно исказит наши оценки, поскольку мы применили этот метод только для узлов в короне актиноптериан, где время происхождения общепринято. быть значительно моложе этого силурийского предела.На практике доверительные интервалы, оцениваемые алгоритмом, относительно нечувствительны к выбору жесткого ограничения максимального возраста.
По мере приближения к хрящевой кроне, с возрастом, указанным в скобках, эта последовательность выглядит так: Birgeria groenlandia (250.1 млн лет назад), Chondrosteus acipenseroides (193.81) и Peipiaosteus pani (129.3). Возрастные обоснования аналогичны тем, которые даны для других таксонов из тех же геологических единиц (например, Chondrosteus acipenseroides встречается совместно с Dorsetichthys bechei , который включен в серию стволовых костистых рыб, указанную под номером ). затем подвергли алгоритму Хедмана с жестким верхним возрастным ограничением 430 млн лет. Этот выбор максимального возраста вряд ли существенно исказит наши оценки, поскольку мы применили этот метод только для узлов в короне актиноптериан, где время происхождения общепринято. быть значительно моложе этого силурийского предела.На практике доверительные интервалы, оцениваемые алгоритмом, относительно нечувствительны к выбору жесткого ограничения максимального возраста.
Наш калибровочный набор ограничен окаменелостями мезозойского и кайнозойского возраста. Это отражает два фактора. Во-первых, клада, представляющая основной интерес для этого анализа, — Teleostei — известна исключительно из мезозойских и более молодых отложений. Во-вторых, связь многих палеозойских окаменелостей с современными линиями актиноптеригов плохо определена (см.в печати), при этом некоторые окаменелости, использовавшиеся в качестве ключевых калибровок в прошлых исследованиях (например, ), были обнаружены в очень разных филогенетических позициях в последующих анализах (например, Giles et al. в печати; ). Вместо потенциально вводящих в заблуждение калибровок для глубоких расхождений в филогенезе актиноптеригов мы вместо этого решили позволить более надежно расположенным окаменелостям, принадлежащим более поздним расходящимся кладам, информировать наши оценки возраста для более инклюзивных групп.
Полученная нами временная шкала истории актиноптеригий хорошо согласуется с эволюционной временной шкалой, подразумеваемой окаменелостями для групп с хорошо изученными палеонтологическими записями.
 . Эта оценка существенно закрывает так называемый «разрыв костистых костей», заметное временное несоответствие между временем происхождения коронных костистых костей, подразумеваемым летописью окаменелостей и некоторыми исследованиями молекулярных часов . Среди вложенных клад костистых, как правило, существует хорошее соответствие между нашей временной шкалой и тем, что подразумевается как предыдущими исследованиями молекулярных часов, так и летописью окаменелостей.
. Эта оценка существенно закрывает так называемый «разрыв костистых костей», заметное временное несоответствие между временем происхождения коронных костистых костей, подразумеваемым летописью окаменелостей и некоторыми исследованиями молекулярных часов . Среди вложенных клад костистых, как правило, существует хорошее соответствие между нашей временной шкалой и тем, что подразумевается как предыдущими исследованиями молекулярных часов, так и летописью окаменелостей.
Мы сравнили таксономическую классификацию по Fishbase , Каталогу рыб и проекту Euteleost Tree of Life . Основываясь на этих таксономических авторах, мы построили новую схему классификации и исследовали более мелкие филогенетические группы, где в нашей филогенезе была обнаружена немонофилия. Эта комбинированная «филогенетическая классификация рыб» (PFC) затем использовалась для таксономического заполнения таксонов без молекулярных данных или тех, которые были удалены на этапе курирования. Используя калиброванную по времени филогению в качестве основы, мы создали псевдоапостериорное распределение 100 синтетических филогений, используя TACT , где отсутствующие таксоны были размещены в соответствии с нашей таксономией PFC, установив вероятность захвата короны на 0,8. Полная информация об этой процедуре доступна в тексте и дополнительных методах .
Используя калиброванную по времени филогению в качестве основы, мы создали псевдоапостериорное распределение 100 синтетических филогений, используя TACT , где отсутствующие таксоны были размещены в соответствии с нашей таксономией PFC, установив вероятность захвата короны на 0,8. Полная информация об этой процедуре доступна в тексте и дополнительных методах .
Мы рассчитали скорости видообразования с помощью трех основных механизмов: с помощью BAMM, с помощью статистики DR и с помощью метода интервальных скоростей.
BAMM использует алгоритм байесовской цепи Маркова с обратимыми скачками Монте-Карло (MCMC) для определения местоположения и оценки параметров различных режимов скорости диверсификации на временной калибровке. BAMM пытается идентифицировать конфигурации сдвига скорости макроэволюции и генерирует распределение апостериорных выборок. Полный набор этих апостериорных выборок может быть суммирован, например, путем вычисления средней скорости для каждой вершины в филогенезе или в виде предельного апостериорного распределения скоростей вершин. {j-1}}
{j-1}}
, где N i — количество узлов между вершиной i и корень, l j — длина ребра j, где j=1 — ребро, ведущее к кончику i.Интуитивно это средневзвешенное обратное значение длин ветвей. DR аппроксимирует скорость видообразования филогении, диверсифицирующейся в процессе Йоля (чистокровного рождения); полное доказательство см. в разделе 1.2.2 дополнения к . Аппроксимация DR истинной скорости видообразования является полезным свойством и может использоваться для перекрестной проверки оценок скорости видообразования, полученных с помощью BAMM.
В качестве третьей независимой оценки скорости видообразования мы используем метод интервальных скоростей или меру плотности узлов.Это оценка скорости видообразования за определенный период времени. Это число узлов, которые существуют в филогении за определенный интервал, деленное на количество времени, которое охватывает этот интервал, и это чрезвычайно простой способ вычислить скорость видообразования.
антарктических рыб со льдом в жилах: как они выживают?
Даже после десятилетий изучения нототениоид, костистая рыба, живущая в холодных водах, продолжает преподносить сюрпризы.
Нототениоидам принадлежат воды вокруг Антарктиды, известные как Южный океан; один из немногих видов, которые могут выжить при температуре морской воды до 29 градусов по Фаренгейту, он составляет более 90 процентов биомассы рыб в регионе. Поэтому неудивительно, что ученые начали исследовать, как эти животные выживают в этой ледяной среде, не замерзая.
Ученые раскрывают поразительные факты о нототениоидах уже более четырех десятилетий, включая открытие в 1960-х годах антифризных белков внутри этих рыб, жизненно важного инструмента для их выживания.Но, согласно новому исследованию, опубликованному в журнале Proceedings of the National Academy of Sciences , исследователи обнаружили, что эти белки могут быть не такими полезными, как считалось раньше. Белки действительно помогают предотвратить замерзание воды в рыбе, но оказывается, что они также предотвращают таяние льда.
«Мы давно знали, что белки-антифризы лежат в основе того, как эти рыбы выживают в условиях замерзания. Но мы все еще прорабатываем детали, и это одна из таких деталей», — Пол Чико. , ведущий автор статьи, сказал Monitor.
Г-н Чико, докторант Орегонского университета, работал с Кристиной Ченг и Артуром ДеВрисом, супружеской командой зообиологов из Иллинойского университета. В конце 1960-х годов Деврис обнаружил, что антифризные белки существуют в телах нототениоидов. В 1990-х годах он обнаружил, что рыбы также несут кристаллы льда в различных органах, таких как жабры и селезенка.
В этом новом исследовании команда Чико тестировала рыб в лаборатории, нагревая их до точки, при которой лед в их телах полностью растаял.Однако это были температуры, которых нототениоиды никогда не испытывают в своей среде. Они также изучили данные о температуре, непрерывно регистрируемые за последние 11 лет в проливе Мак-Мердо, Антарктида.
Исследовательская группа обнаружила, что кристаллы льда не растаяли при ожидаемой температуре плавления около 30 градусов по Фаренгейту, а вместо этого остались целыми. Рыба продолжала содержать лед даже после того, как исследователи подняли температуру еще на 1,8 градуса по Фаренгейту, и это произошло в первую очередь из-за белка-антифриза.
Рыба продолжала содержать лед даже после того, как исследователи подняли температуру еще на 1,8 градуса по Фаренгейту, и это произошло в первую очередь из-за белка-антифриза.
Хотя спасательный белок получил название «антифриз», по словам Чико, он действует иначе, чем, скажем, жидкость, которую вы смешиваете с жидкостью для стеклоочистителей. Вместо того, чтобы действовать как соль и снижать температуру замерзания, белки-антифризы нототениоидов связываются с кристаллами льда в их телах и изменяют поверхность кристаллов, так что им трудно расти.
Этот механизм не только затрудняет рост кристаллов льда.Белки настолько прочно связываются друг с другом, что льду становится трудно уменьшаться даже при температурах выше нуля.
«Когда люди изучают белки-антифризы, они смотрят на способность организмов справляться с холодными, а не с теплыми температурами», — говорит Чико. «Все их внимание сосредоточено на том, насколько это защищает от замерзания?» и люди просто упустили из виду, что также может быть важный эффект против таяния».
В контролируемых условиях ученым удалось нагреть лед выше его точки плавления, не дав льду растаять.Но Чико говорит, что это может быть первый пример «перегрева» в природе.
Так что же означает для рыб этот перегретый лед? Даже в несколько более теплые летние месяцы, когда нототениоид имеет шанс оттаять, некоторые кристаллы льда остаются.
Есть ли какое-либо неблагоприятное воздействие на организм рыб, до сих пор неизвестно. По словам Чико, стоимость белка в долгосрочной перспективе требует дальнейших исследований.
«Если они могут терпеть это, возможно, они развили какой-то другой механизм, чтобы справиться с этими кристаллами льда внутри их тел», — говорит Чико.«И, возможно, в долгосрочной перспективе это действительно убивает рыбу, и они не так хорошо справляются с этим».
Наибольшая концентрация кристаллов льда находится в селезенке рыб. Чико говорит, что, возможно, селезенка пытается отфильтровать эти кристаллы льда из крови, чтобы они не вызывали проблем в других частях тела.



 Подробнее о проблемах можно прочитать здесь. Nantucket Wild Gourmet & Smokehouse занимается устойчивыми морепродуктами, предлагая рыбу, пойманную на удочку, которую коптят небольшими партиями с использованием кустарных методов. Линия сертифицирована как кошерная.
Подробнее о проблемах можно прочитать здесь. Nantucket Wild Gourmet & Smokehouse занимается устойчивыми морепродуктами, предлагая рыбу, пойманную на удочку, которую коптят небольшими партиями с использованием кустарных методов. Линия сертифицирована как кошерная.  К ним относятся гуманно.
К ним относятся гуманно.  Рыба, выращенная на ферме, питается одной и той же пищей и имеет одинаковый вкус; последовательность – это название игры. Дикая рыба — это совершенно другой опыт — ее вкус отражает то, что они ели в дикой природе, каждая рыба будет иметь разный вкус (на самом деле у нас было две партии аляскинского королевского лосося, которые выглядели и имели вкус разных видов лосося; разница в том, что более темный, с более соленой мякотью обедал кальмаром!).
Рыба, выращенная на ферме, питается одной и той же пищей и имеет одинаковый вкус; последовательность – это название игры. Дикая рыба — это совершенно другой опыт — ее вкус отражает то, что они ели в дикой природе, каждая рыба будет иметь разный вкус (на самом деле у нас было две партии аляскинского королевского лосося, которые выглядели и имели вкус разных видов лосося; разница в том, что более темный, с более соленой мякотью обедал кальмаром!).  )
)  Хотя нам понравилось, как эта красивая, блестящая желтая рыба появилась на тарелке, это была не хорошая «съедобная рыба», а рыба для приготовления пищи. В то время как черная треска, голубая рыба и лосось имеют маслянистое мясо, пикша представляет собой тонкую, сухую белую рыбу.Копченый, его нельзя есть на тарелке или класть на рогалик или канапе, как другие. Скорее, соленое филе в основном используется в кулинарии — для похлебки, хэдди по-финнански*, рыбных котлет и т. д.
Хотя нам понравилось, как эта красивая, блестящая желтая рыба появилась на тарелке, это была не хорошая «съедобная рыба», а рыба для приготовления пищи. В то время как черная треска, голубая рыба и лосось имеют маслянистое мясо, пикша представляет собой тонкую, сухую белую рыбу.Копченый, его нельзя есть на тарелке или класть на рогалик или канапе, как другие. Скорее, соленое филе в основном используется в кулинарии — для похлебки, хэдди по-финнански*, рыбных котлет и т. д.  Это не настоящая треска (атлантическая треска — Gadus morhua ). Черная треска ( Anoplopoma fimbria ), которую называют черной треской, даже не является настоящей черной треской ( Notothenia microlepidota ), ледяной рыбой южного полушария. Все-таки мы не ихтиологи, мы просто любим съесть хороший кусок рыбы. Черная треска/черная рыба не только полезна, но и полезна для вас: в ней столько же длинноцепочечных омега-3 жирных кислот (ЭПК и ДГК), сколько в диком лососе, его соседе с Аляски.
Это не настоящая треска (атлантическая треска — Gadus morhua ). Черная треска ( Anoplopoma fimbria ), которую называют черной треской, даже не является настоящей черной треской ( Notothenia microlepidota ), ледяной рыбой южного полушария. Все-таки мы не ихтиологи, мы просто любим съесть хороший кусок рыбы. Черная треска/черная рыба не только полезна, но и полезна для вас: в ней столько же длинноцепочечных омега-3 жирных кислот (ЭПК и ДГК), сколько в диком лососе, его соседе с Аляски.  Этот парень съел много кальмаров.
Этот парень съел много кальмаров. 
 com
com